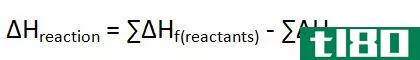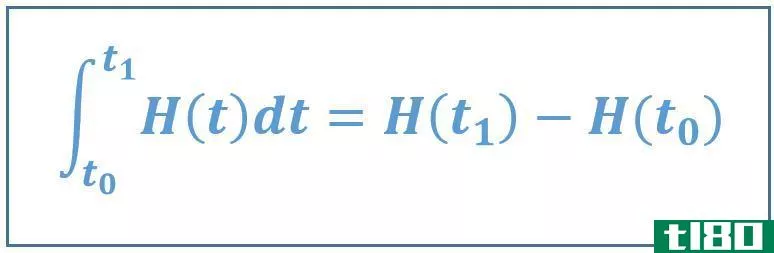焓和熵之间的关键区别在于,焓是在恒定压力下发生的热传递,而熵给出了系统随机性的概念。
为了化学研究的目的,我们把宇宙分成两个系统和一个环境。在任何时候,我们要研究的部分是系统,其余的都是围绕着系统。焓和熵是描述系统和周围环境中发生的反应的两个术语。焓和熵都是热力学态函数。
目录
1.概述和主要区别
2. 什么是焓
3. 什么是熵
4. 并列比较-表格式的焓与熵
5. 摘要
什么是焓(enthalpy)?
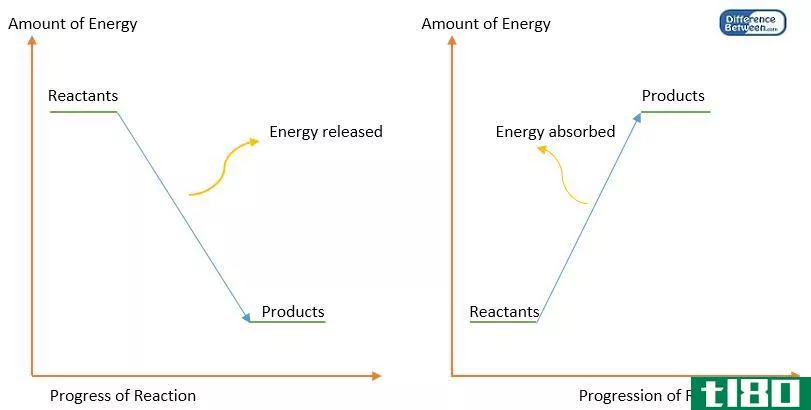
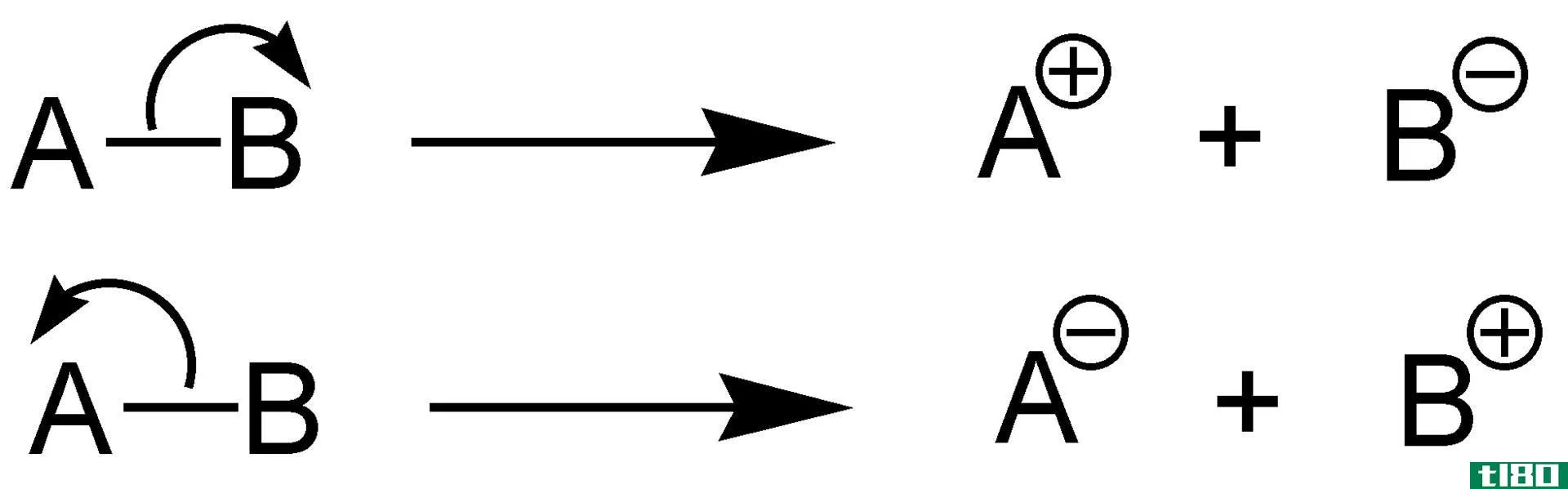
当一个反应发生时,它可能吸收或放出热量,如果我们在恒压下进行反应,我们称之为反应的焓。然而,我们不能测量分子的焓。因此,我们需要测量反应过程中焓的变化。通过从产物的焓值中减去反应物的焓,我们可以得到在给定温度和压力下反应的焓变化(∆H)。如果该值为负值,则反应是放热的。如果值为正,则反应是吸热的。
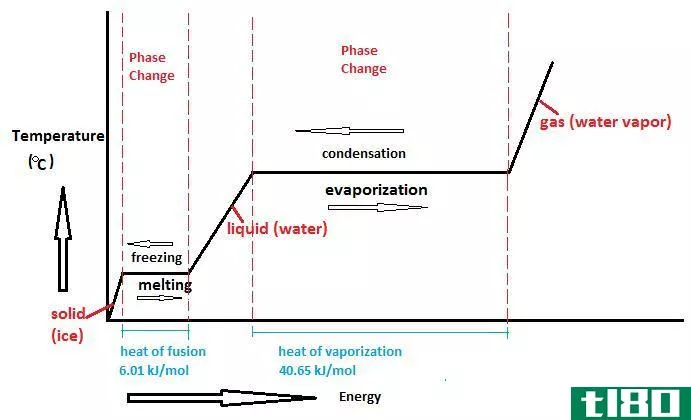
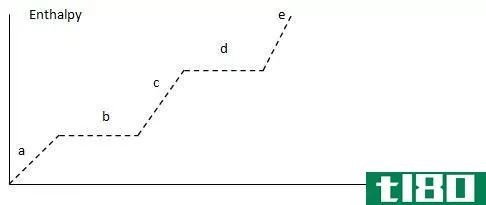
图01:焓变和相变之间的关系
任何一对反应物和产物之间的焓变化与它们之间的路径无关。此外,焓的变化取决于反应物的相。例如,当氧气和氢气反应生成水蒸气时,焓变为-483.7kj。当相同反应物反应生成液态水时,焓变为-571.5kj。
2H2(g)+O2(g)→2H2O(g);∆H=-483.7千焦
2H2(g)+O2(g)→2H2O(l);∆H=-571.7 kJ
什么是熵(entropy)?
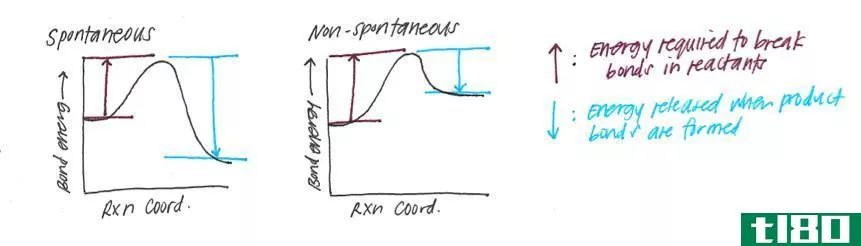
有些事情是自发发生的,有些则不是。例如,热会从热的物体流向较冷的物体,但我们不能观察到相反的情况,即使它不违反能量守恒定律。当发生变化时,总能量保持不变,但分配方式不同。我们可以通过能量的分布来确定变化的方向。一个变化是自发的,如果它导致更大的随机性和整个宇宙的混乱。我们可以用一个状态函数来度量混沌、随机性或能量的分散程度,我们称之为熵。
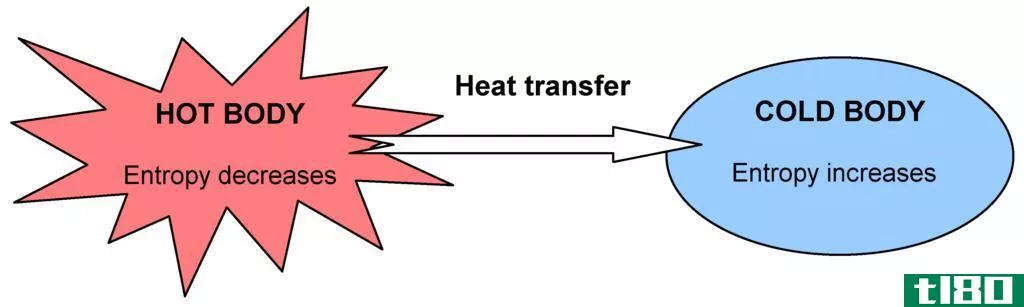
图02:熵随热传递的变化图
热力学第二定律与熵有关,它说:“宇宙的熵在自发过程中增加。”熵和产生的热量根据系统使用能量的程度相互关联。事实上,由给定热量q引起的熵变或额外无序度的大小取决于温度。如果它已经很热了,一点额外的热量不会造成更多的混乱,但是如果温度非常低,同样的热量会导致无序的急剧增加。因此,我们可以这样写:(ds在熵中变化,dq在热中变化,T是温度。
ds=dq/T
焓(enthalpy)和熵(entropy)的区别
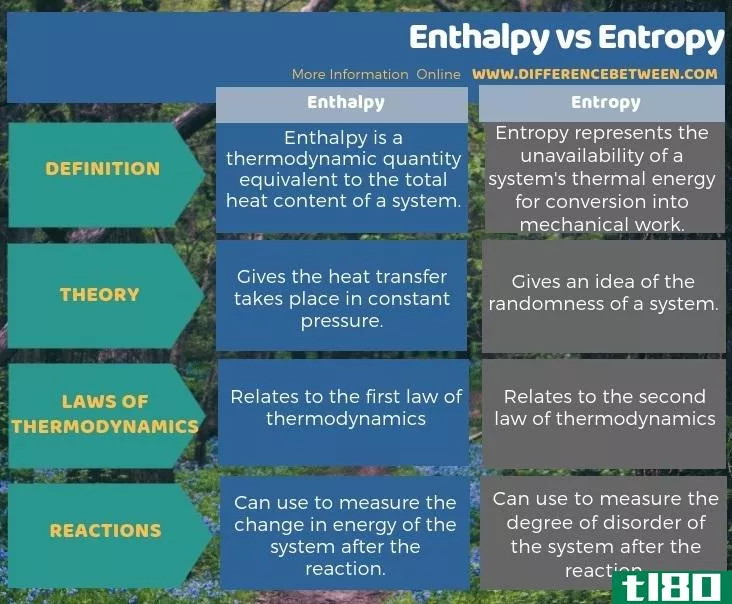
焓和熵是热力学中两个相关的术语。焓和熵之间的关键区别在于,焓是在恒定压力下进行的传热,而熵给出了系统随机性的概念。此外,焓与热力学第一定律有关,熵与热力学第二定律有关。焓和熵的另一个重要区别是,我们可以用焓来衡量反应后系统的能量变化,而我们可以用熵来衡量反应后系统的无序程度。
总结 - 焓(enthalpy) vs. 熵(entropy)
焓和熵是化学反应中常用的热力学术语。焓和熵之间的关键区别在于,焓是在恒定压力下进行的传热,而熵给出了系统随机性的概念。
引用
1歌词。“焓”,化学剧本,国家科学基金会,2018年11月26日。这里有2个。Drake,Gordon W.F.“熵”,《大英百科全书》,2018年6月7日,可在此处查阅
2Drake,Gordon W.F.“熵”,《大英百科全书》,2018年6月7日