結合エネルギーの計算方法
結合エネルギーは化学の重要な概念で、共有結合している気体間の結合を切断するのに必要なエネルギー量を定義している。このような結合エネルギーはイオン結合には当てはまらない。2つの原子が結合して新しい分子をつくるとき、その結合を切るのに必要なエネルギー量を測定することで、原子間の結合の強さを知ることができるのです。個々の原子は結合エネルギーを持たず、エネルギーを持つのは2つの原子の間の結合であることを忘れてはならない。反応の結合エネルギーを計算するには、単純に壊れた結合の総数を求め、形成された結合の総数を引けばよい...。
第1部/第2部:形成された割れ目と結合を確認する
- 1 結合エネルギーの計算式を決定する。結合エネルギーは、切れた結合の総和からできた結合の総和を引いたもので、ΔH = ∑H(切れた結合)- ∑H(できた結合)です。ΔHは結合エネルギーの変化で、結合エンタルピーとも呼ばれ、∑Hは式の両側の結合エネルギーの総和になります。この式は、ヘスの法則の一形態である。結合エネルギーの単位はキロジュール/モル、kJ/モルである。
- 分子間の化学結合をすべて示す化学方程式を書きなさい。化学記号と数字だけで書かれた反応式が与えられた場合、様々な元素や分子の間に形成されるすべての化学結合を示すために、この反応式を描くことが有効である。式の左辺はすべての反応物、右辺はすべての生成物を示していることを忘れないでください。単結合、二重結合、三重結合は結合エネルギーが異なるので、必ず元素間の結合を正しく使って図を描いてください。例えば、2個の水素と2個の臭素の反応について、次のような式を描くとします。 H2(g) + Br2(g) ---> 2 HBr(g) となるのです。ハイフンは、反応物と生成物の元素の間の単結合を表します。
- 3 破砕と形成のための結合の計算規則を知っている。ほとんどの場合、これらの計算で使用する結合エネルギーは平均化されます。同じ結合でも、それが形成する分子によって結合エネルギーが若干異なる場合があるため、一般的には平均的な結合エネルギーが用いられる...単結合、二重結合、三重結合はすべて1つの切れ目として扱われます。これらはすべて結合エネルギーが異なるが、1回の切断としてカウントされる。単結合、二重結合、三重結合を形成する場合も同様である。1つのフォーメーションとしてカウントされます。この例では、すべての債券が単結合である。
- 4 式の左辺の壊れた結合を決定する。左側には反応物が入っています。これらは、方程式の中のすべての壊れた結合を表します。これは吸熱過程であり、結合を切断するためのエネルギー吸収が必要である。この例では、左側にH-H結合が1つ、Br-Br結合が1つあります。
- 5 式の右辺に形成される結合を計算する。右側には、すべての製品が表示されます。これらはすべて、絆を形成するものです。これは、エネルギーを放出するプロセスで、通常は熱の形で放出されます。この例では、右側にH-Br結合が2つある。

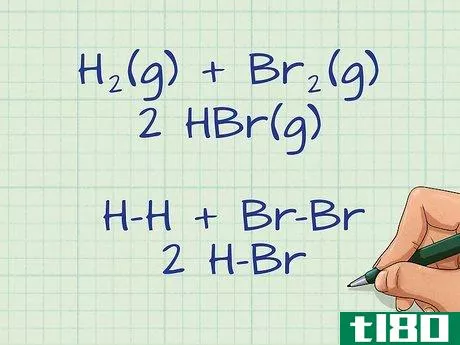



第2部 第2部:結合エネルギーの計算
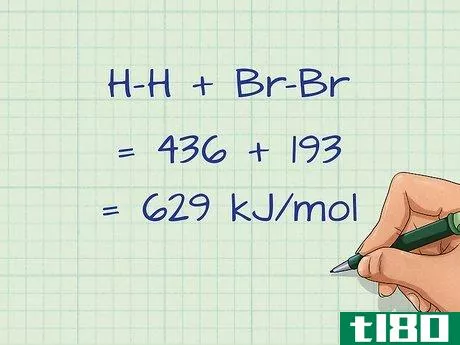
- 1 問題の結合の結合エネルギーを求めよ。特定の結合の平均結合エネルギーに関する情報が記載された表は数多く存在する。これらの表は、インターネットや化学の本で見ることができます。注目すべきは、これらの結合エネルギーは常に気体状態の分子に対するものであることだ。H-H = 436 kJ/mol; Br-Br = 193 kJ/mol; H-Br = 366 kJ/mol 液体分子の結合エネルギーを計算するには、液体分子の蒸発エンタルピー変化も調べる必要があります。これは、液体を気体に変えるのに必要なエネルギーです。この数値は、全結合エネルギーに加算されなければならない。例もし、液体の水が得られたら、水の蒸発によるエンタルピー変化(+41kJ)を式に加える必要があります。
- 2 結合エネルギーに切断された結合の数を乗じる。方程式によっては、同じボンドが複数回切れることがあります。例えば、分子中に水素原子が4つある場合、水素の結合エネルギーは4回計算する、つまり4倍する必要があります。この例では、1分子に1つしか結合がないので、結合エネルギーは1倍するだけです。 H-H = 436 x 1 = 436 kJ/molBr-Br = 193 x 1 = 193 kJ/mol
- 3 切断されたすべての結合のエネルギーを足し算する。結合エネルギーに個々の結合の数をかけたら、反応する側の結合をすべて足し算する必要があります。この例の場合、切れた結合の合計は、H-H + Br-Br = 436 + 193 = 629 kJ/molとなる。
- 4 形成された結合の数に結合エネルギーを乗じる。反応物の片側で切れる結合の場合と同じように、形成された結合の数にそれぞれの結合エネルギーを掛けます。この例では、2つのH-Br結合が形成されているので、H-Brの結合エネルギー(366 kJ/mol)は、2倍され、366 x 2 = 732 kJ/molとなります。
- 5 形成されたすべての結合のエネルギーを足し算する。ここでも、切れた結合のときと同じように、製品側にできた結合をすべて足し算します。この例では、生成物は1つだけなので、形成された結合のエネルギーは、ちょうど2つのH-Br結合のエネルギー、つまり732 kJ/molとなります。
- 6 切断された結合から形成された結合を引き算する。両者の結合エネルギーをすべて足し合わせたら、切れた結合からできた結合を引くだけでいい。ΔH=∑H(結合の切断)-∑H(結合の形成)この公式を覚えておいてください。計算値を挿入し、減算する。例:ΔH = ∑H(結合破壊) - ∑H(結合形成) = 629 kJ/mol - 732 kJ/mol = -103 kJ/mol.
- 7 反応全体が吸熱であるか発熱であるかを判断する。結合エネルギーの計算の最終段階は、その反応がエネルギー放出型なのかエネルギー消費型なのかを判断することです。吸熱反応(エネルギーを消費する反応)は、最終的な結合エネルギーが正になり、発熱反応(エネルギーを放出する反応)は、結合エネルギーが負になります。この例では、最終的な結合エネルギーは負であり、したがって反応は発熱的である。






- 2022-03-11 13:22 に公開
- 閲覧 ( 8 )
- 分類:教育