化学における結合次数の計算方法(化学における結合次数の計算方法)
原子レベルでは、2つの原子の間の結合電子対の数が結合順となる。例えば、2原子の窒素(n≡n)の場合、2つの窒素原子を結ぶ化学結合が3つあるため、結合の順番は3である。また、分子軌道理論では、結合次数は結合電子と反結合電子の数の差の半分と定義されている。わかりやすく答えるなら:この式を使ってください。結合次数=[(結合分子の電子数)-(反結合分子の電子数)]/2...です。
方法1 方法1/3:債券の注文を素早く見つける。
- 1 式を知る。分子軌道理論では、結合分子と反結合分子の電子数の差の半分を結合次数と定義している。結合次数=[(結合分子の電子数)-(反結合分子の電子数)]/2。
- 2 結合列が多いほど分子が安定することがわかる。結合した分子の軌道に入った電子は、それぞれ新しい分子を安定化させるのに役立つ。反結合分子軌道に入った電子は、新しい分子を不安定にする。なお、新しいエネルギー状態は、分子の結合次数である。結合次数が0であれば、分子を形成することはできない。結合次数が高いほど、新しい分子がより安定であることを示している。
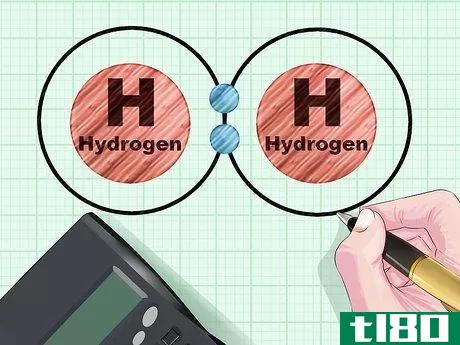
- 3 簡単な例で考えてみましょう。水素原子はs殻に1個の電子を持っており、s殻は2個の電子を保持することができる。2つの水素原子が結合すると、それぞれがもう一方の水素原子のs殻を完成させる。2つの結合軌道が形成される。電子は次の上位軌道であるp殻に強制的に移動させられることはなく、反結合軌道は形成されない。したがって、結合の順番は(2-0)/2{displaystyle(2-0)/2}となり、1になる。これが共通の分子H2:水素ガスとなる。

方法2 3つのうちの方法2:可視化のための基本的な結合順序
- 1 ボンドオーダーを一目で判断できる。一重共有結合は結合次数1、二重共有結合は結合次数2、三重共有結合は結合次数3......といった具合である。最も基本的な形は、2つの原子を結合する結合電子対の数である結合次数である。もっと詳しく知りたい方は、周期表でどんな結合があるのか確認してみてください。
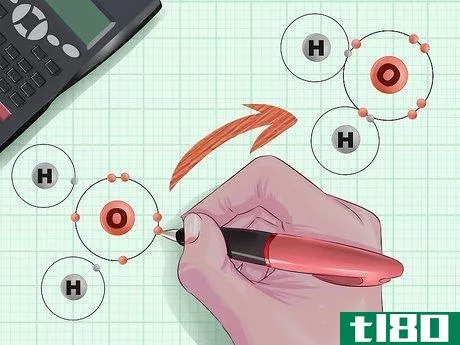
- 2 原子が結合して分子を形成する仕組みを考える。分子は、構成する原子と原子が電子の対で結合している。これらの電子は、原子核の周りを「軌道」という形で回転しており、それぞれの軌道には2個しか電子を保持できない。軌道が「満杯」でない場合、すなわち電子を1個しか保持していない場合、あるいは電子がない場合、不対電子は他の原子の対応する自由電子と結合することができます。大きな原子は小さな原子より多くの電子を持っているため、電子の収集は軌道の殻を広げながら続いていく。
- ルイスドット構造の3D図面。これは、分子内の原子がどのように結合しているかを視覚化するのに便利な方法です。原子をアルファベットで書きなさい(例:Hは水素、Clは塩素)。単結合は-、二重結合は=、三重結合は≡など、線を使って結合の仕方を説明する。結合していない電子や電子対をドットでマークする(例:C:)。ルイスドット構造を描いたら、結合の数を数えます:これが結合の順番です。二原子窒素のルイスドット構造はN≡Nで、各窒素原子は1つの電子対と3つの非結合電子を持っています。2つの窒素原子が出会うと、その6個の非結合電子が絡み合って強い3価の結合を形成する。

方法3 方法3:軌道理論に基づく結合次数の計算
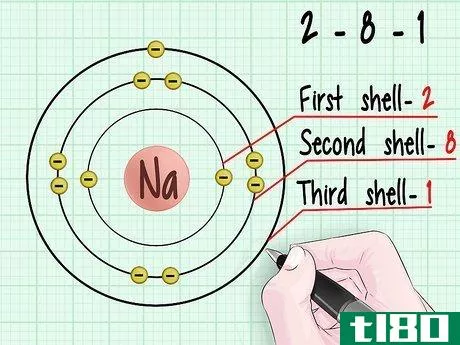
- 1 電子軌道の殻の図を見てください。各殻は核からどんどん離れていくことに注意してください。エントロピーの性質によれば、エネルギーは常に可能な限り低い秩序状態を求めている。電子は、利用可能な最も低い軌道の殻を埋めようとする。
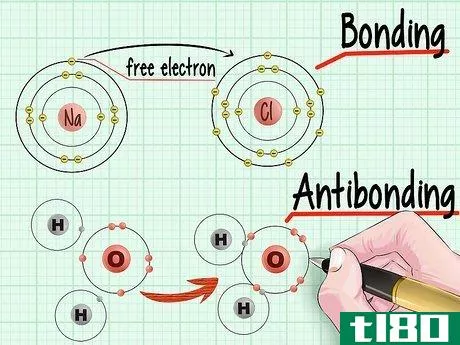
- 2 結合軌道と反結合軌道の違いを知ることができる。2つの原子が集まって分子を形成するとき、原子は互いの電子を利用して、電子軌道殻の最も低い状態を埋めようとする。結合電子とは、本来、電子同士がくっついて一番下の状態になるものです。反結合電子とは、より高い軌道状態に押し出された「自由な」または結合していない電子のことである。結合電子のこと。各原子の軌道殻がどれだけ満ちているかを見れば、対応する原子のより安定な低エネルギー状態の殻を、より高いエネルギー状態の電子がどれだけ埋められるかがわかるのだ。この「充填電子」のことを「結合電子」という。反結合電子。2つの原子が電子を共有して分子を形成しようとすると、実際には低エネルギー状態の軌道殻が埋まっているため、一部の電子は高エネルギー状態の軌道殻に追いやられることになる。これらの電子は反結合電子と呼ばれる。
- 2022-03-11 13:23 に公開
- 閲覧 ( 13 )
- 分類:教育