键的极性(bond polarity)和分子极性(molecular polarity)的区别
主差键极性(main difference bond polarity) vs. 分子极性(molecular polarity)
在化学中,极性是指导致分子产生偶极矩的电荷分离。在这里,部分正电荷和部分负电荷在键或分子中分开。这主要是因为原子电负性值的不同。原子的电负性是电子吸引程度的量度。当两个原子通过共价键相互结合时,键电子被吸引到最负电的原子。由于周围电子密度很高,这就给了这个原子一部分负电荷。相应地,其他原子得到部分正电荷。最终的结果是极性键。这是由键极性来描述的。分子极性是整个分子的极性。键极性和分子极性的主要区别在于键极性解释了共价键的极性,而分子极性解释了共价分子的极性。
覆盖的关键领域
1.什么是键极性-定义、极性、举例说明2.什么是分子极性-定义、极性、举例说明3.键极性和分子极性的区别是什么-主要区别的比较
关键词:原子,共价,偶极矩,电子,电负性,非极性,极性,极性键

什么是键的极性(bond polarity)?
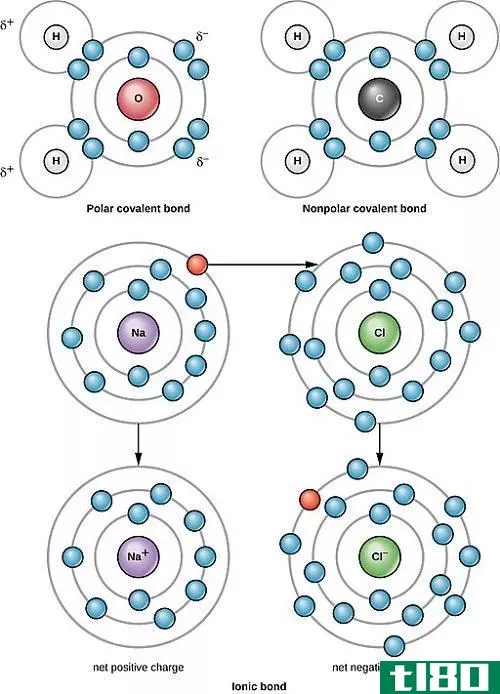
键极性是解释共价键极性的一个概念。共价键是两个原子共用其未配对电子时形成的。那么,键合电子或参与键合的电子都属于这两个原子。因此两个原子之间有一个电子密度。
如果两个原子的化学元素相同,那么就不能观察到键的极性,因为两个原子对键电子的吸引力相等。但是如果这两个原子属于两种不同的化学元素,那么负电荷越多的原子会比负电荷越小的原子吸引键电子。然后,由于原子周围的电子密度降低,电负性较低的原子得到部分正电荷。但是电负性越强的原子会得到部分负电荷,因为原子周围的电子密度越高。这种电荷分离在共价键中称为键极性。
当电荷分离时,这种键称为极性键。在没有键极性的情况下,它被称为非极性键。为了理解键的极性,让我们考虑两个例子。
键极性示例
囊性纤维变性
在这里,C原子的电负性比F原子小。因此,键电子更容易被F原子吸引。然后,F原子获得部分负电荷,而C原子获得部分正电荷。

Figure 1: CF
氢气
这里,两个氢原子通过共价键相互结合。由于两个原子具有相同的电负性,因此一个原子没有净吸引力。因此,这是一个没有电荷分离的非极性键。
什么是分子极性(molecular polarity)?
分子极性是解释共价化合物极性的概念。这里,考虑了分子中的整体电荷分离。为此,分子中存在的每一个共价键的极性被使用。
化合物按分子极性可分为极性化合物和非极性化合物。分子极性在分子中产生偶极矩。分子的偶极矩是两个相反电荷分离形成的偶极子。
分子的极性主要取决于分子的几何结构。当分子几何结构对称时,不存在净电荷分离。但是如果几何结构是不对称的,则存在净电荷分离。让我们考虑一个例子来解释这个概念。
分子极性的例子
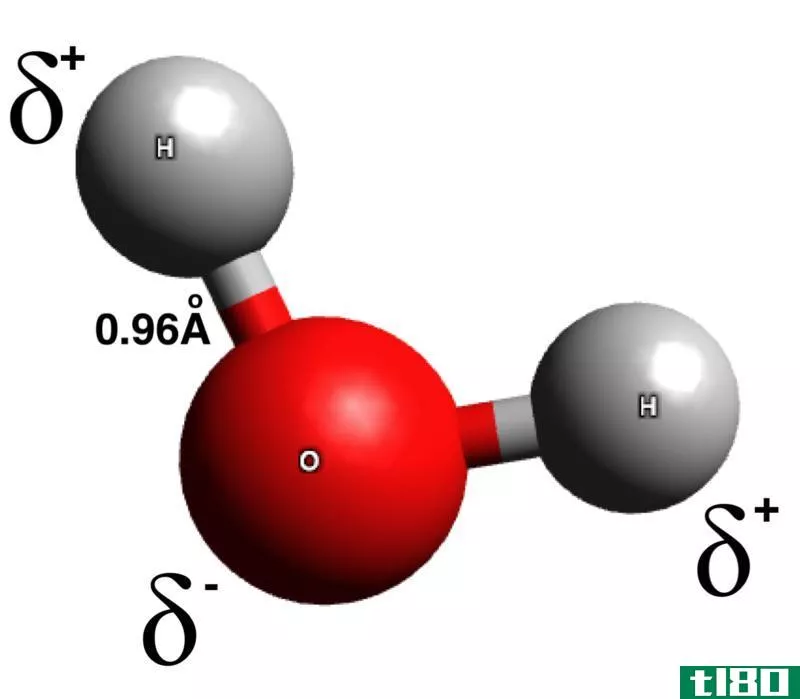
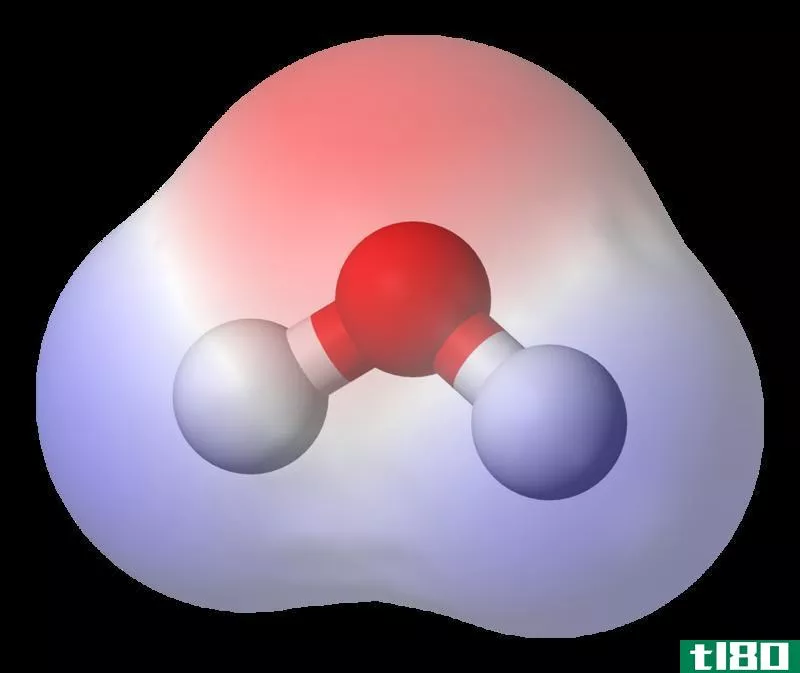
水
水分子由于电荷分离而具有偶极矩。在那里,氧比氢原子更负电。因此,键电子更容易被氧原子吸引。水分子的分子几何是不对称的:三角平面。因此,水分子表现出分子极性。

Figure 2: H2o
二氧化碳
这个分子有两个极性C=O键。但是分子几何是线性的。那么就没有净电荷分离。因此,二氧化碳是一种非极性分子。
键的极性(bond polarity)和分子极性(molecular polarity)的区别
定义
键极性:键极性是解释共价键极性的概念。
分子极性:分子极性是解释共价化合物极性的概念。
影响极性的因素
键极性:键极性取决于参与键合的原子的电负性值。
分子极性:分子极性主要取决于分子的分子几何。
不同类型
键极性:键极性导致极性共价键和非极性共价键的形成。
分子极性:分子极性导致极性共价化合物和非极性共价化合物的形成。
结论
键或分子的极性是解释电荷分离的概念。键极性是由于原子电负性值的不同而产生的。分子的极性主要取决于分子的几何形状。然而,键极性和分子极性的主要区别在于键极性解释了共价键的极性,而分子极性解释了共价分子的极性。
引用
1.“8.4:键极性和电负性”,化学剧本,剧本,2017年8月28日,可在这里获得。2.“分子极性”,化学剧本,剧本,2016年7月21日,可在这里获得。 2.“分子极性”,化学剧本,剧本,2016年7月21日,
- 发表于 2021-06-29 20:34
- 阅读 ( 463 )
- 分类:科学
你可能感兴趣的文章
极地的(polar)和偶极分子(dipolar molecules)的区别
...要 什么是极性分子(polar molecules)? 极性分子是具有极性键的化学物质。这些极性键的偶极矩之和不等于零。极性键有部分正电荷端和部分负电荷端。这些电荷是由于整个化学键中电子分布的差异而产生的。电子分布的差异是化...
- 发布于 2020-09-24 05:10
- 阅读 ( 532 )
键偶极子(bond dipole)和分子偶极子(molecular dipole)的区别
...,键偶极子和分子偶极子是相同的。 什么是分子偶极子(molecular dipole)? 分子偶极子是指同一分子中存在两个相反的带电端。这种偶极矩是由于分子的净极性而产生的。分子的净极性或整体极性取决于分子的形状和每个化学键的...
- 发布于 2020-10-01 16:53
- 阅读 ( 1020 )
极地的(polar)和非极性溶剂(nonpolar solvents)的区别
...烷、己烷、苯、甲苯等。 此外,极性溶剂中有带有极性键的分子(由于键中原子的电负性不同,这些键显示电荷分离)。非极性溶剂中含有化学键的分子,这些化学键由具有几乎相似电负性的原子组成。 总结 - 极地的(polar) vs. ...
- 发布于 2020-10-12 14:40
- 阅读 ( 493 )
盐桥(salt bridge)和氢键(hydrogen bond)的区别
...种微弱的吸引力。但是,与其他类型的分子内作用力(如极性相互作用、非极性非极性相互作用(如范德瓦尔力)相比,氢键的强度更大。 Usually, hydrogen bonds form between polar covalent molecules. These molecules contain polar covalent bonds, which f...
- 发布于 2020-10-14 03:27
- 阅读 ( 971 )
极地的(polar)和非极性氨基酸(nonpolar amino acids)的区别
关键区别-极性氨基酸与非极性氨基酸 氨基酸按极性可分为极性氨基酸和非极性氨基酸两大类。极性氨基酸与非极性氨基酸的主要区别在于极性氨基酸具有极性,而非极性氨基酸则没有极性。 氨基酸是有机化合物。氨基酸由...
- 发布于 2020-10-19 04:50
- 阅读 ( 1158 )
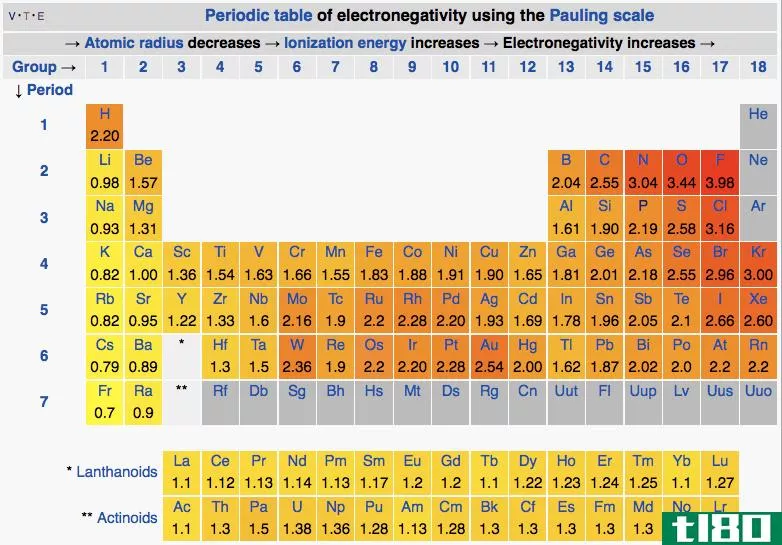
电负性(electronegativity)和极性(polarity)的区别
...电子。 图01:元素周期表中元素的电负性 电负性在决定键的性质方面也很重要。如果键中的两个原子没有电负性差异,则会形成共价键。如果两者之间的电负性差很大,则会形成离子键。 什么是极性(polarity)? 极性是由于原子...
- 发布于 2020-10-22 10:07
- 阅读 ( 892 )
极地的(polar)和非极性(non-polar)的区别
极性与非极性 当我们第一次了解化学时,我们大多数人都觉得它有趣而令人兴奋。但是当你只研究化学性质,化学键,元素表等等的时候,你会觉得很无聊。我们在记忆不同的属性,不同的过程,以及更多的东西时会感到沮丧...
- 发布于 2021-06-23 19:30
- 阅读 ( 397 )
非极性(non-polar)和极性共价键(polar covalent bonds)的区别
...键 非极性和极性共价键既属于极性的三类,也属于共价键的两类。所有这三种类型(离子、极性和非极性)都被归类为化学键,其中有一种力(电负性)允许两种特定元素的原子相互吸引。可能的共价键的数目由特定元素的电...
- 发布于 2021-06-24 05:05
- 阅读 ( 608 )
介电常数(dielectric constant)和极性(polarity)的区别
...电容之比。 它可以用专门的仪器直接测量。 什么是极性(polarity)? 极性是物体在相反的方向或部分具有相反的力量或性质,或在相反的部分或方向上表现出相反的力量或性质的状态或性质。 极性是一个应用广泛的术语,在...
- 发布于 2021-06-26 04:32
- 阅读 ( 742 )
极地的(polar)和非极性键(nonpolar bonds)的区别
...根据所涉及的原子类型,共享的一对电子不会一直驻留在键的中心。有些元素对电子的亲和力比其他元素高。因此,键内的电子倾向于被对电子有较高亲和力的元素吸引。结果,键在电子位置上表现出不平衡。这种现象叫做“极...
- 发布于 2021-06-27 10:16
- 阅读 ( 403 )