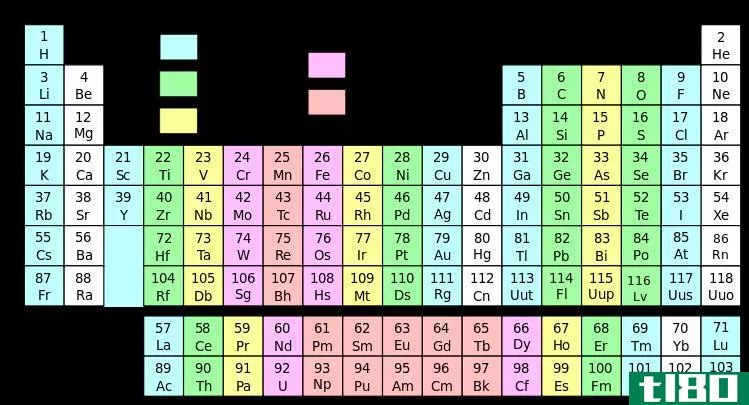
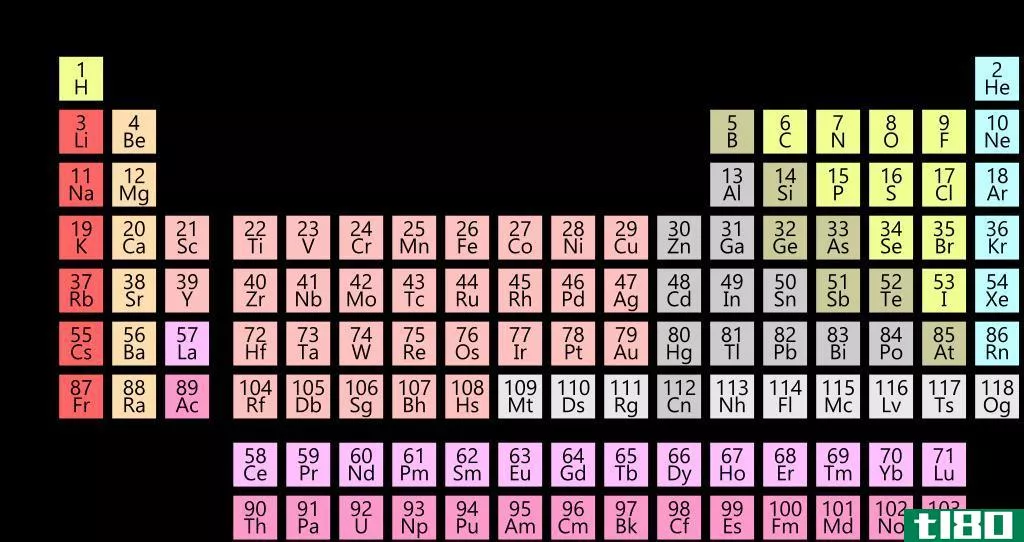
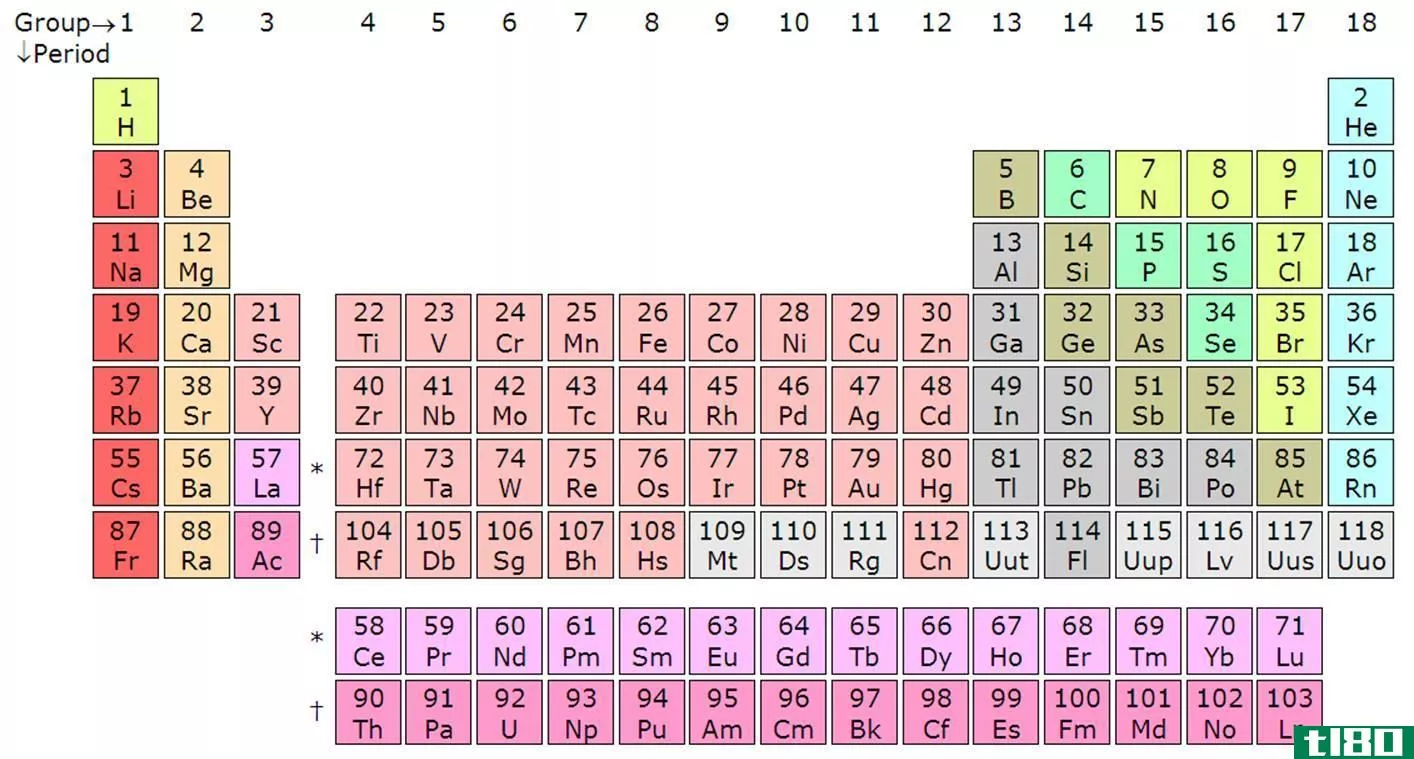
元素群周期表
元素周期表如此有用的一个原因是,它是一种根据元素相似性质排列元素的方法。这就是周期性或周期表趋势的含义。

对元素进行分组有多种方式,但通常分为金属、半金属(类金属)和非金属。你会发现更特殊的基团,如过渡金属、稀土、碱金属、碱土、卤素和惰性气体。
元素周期表中的群
单击某个元素以阅读该元素所属组的化学和物理属性。
碱金属
- 比其他金属密度小
- 一个松散束缚价电子
- 高反应性,反应性增加,向下移动
- 元素在其周期内的最大原子半径
- 低电离能
- 低电负性
碱土金属
- 价层中的两个电子
- 容易形成二价阳离子
- 低电子亲和力
- 低电负性
过渡金属
镧系元素(稀土)和锕系元素也是过渡金属。基本金属与过渡金属相似,但倾向于较软并暗示非金属性质。在纯状态下,所有这些元素都具有闪亮的金属外观。虽然还有其他元素的放射性同位素,但所有锕系元素都具有放射性。
- 非常坚硬,通常有光泽、韧性和延展性
- 高熔点和高沸点
- 高导热性和高导电性
- 形态阳离子(正氧化态)
- 倾向于表现出一种以上的氧化状态
- 低电离能
类金属或半金属
- 电负性和电离能介于金属和非金属之间
- 可能具有金属光泽
- 可变密度、硬度、导电性和其他特性
- 通常是好的半导体
- 反应性取决于反应中其他元素的性质
非金属
卤素和惰性气体是非金属的,尽管它们也有自己的基团。
- 高电离能
- 高电负性
- 导电和导热不良
- 形成脆性固体
- 几乎没有金属光泽
- 容易获得电子
卤素
卤素表现出彼此不同的物理性质,但确实具有相同的化学性质。
- 极高电负性
- 非常活泼
- 七个价电子,所以这组元素通常表现出-1氧化状态
惰性气体
惰性气体有完整的价电子壳层,所以它们的作用不同。与其他基团不同,惰性气体不活泼,电负性或电子亲和力很低。
元素群周期表
单击表中的图元符号以了解更多信息。
- 发表于 2021-09-11 17:13
- 阅读 ( 245 )
- 分类:化学
你可能感兴趣的文章
钋(polonium)和钚(plutonium)的区别
...数为84,符号为Po的化学元素。它是一个p块元素,存在于周期表的第16组周期6中。此外,它属于后过渡金属系列。这个系列的金属元素位于过渡金属和类金属之间。钋的电子构型为[Xe]4f145d106s26p4。在标准温度下,它存在于标准的...
- 发布于 2020-10-07 11:58
- 阅读 ( 322 )
第1组(group 1)和第2组元素(group 2 elements)的区别
...对的电子,而第2组元素的最外层轨道上都有成对电子。 周期表的第1组和第2组包含s块元素。这意味着,这些元素的最外层电子在s轨道上。第1组和第2组的区别取决于它们最外层轨道上的电子数。一个s轨道只能包含两个电子,因...
- 发布于 2020-10-15 03:15
- 阅读 ( 956 )
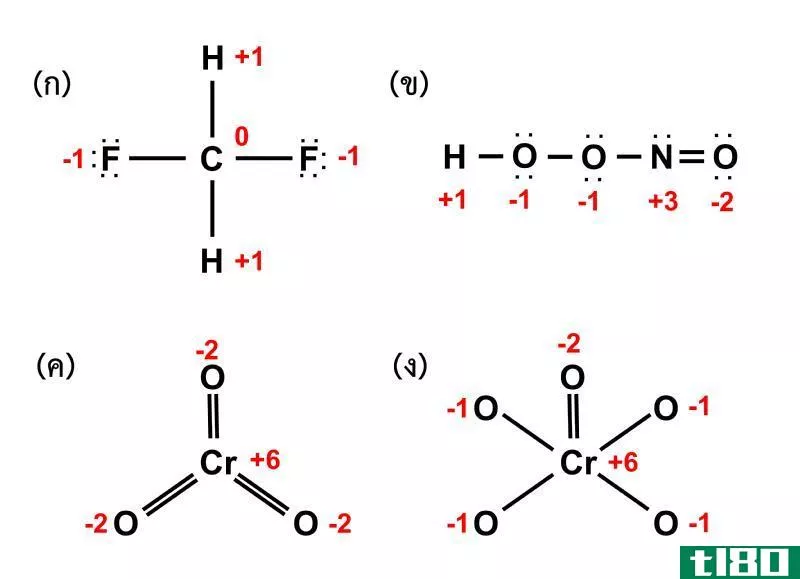
氧化值(oxidation number)和指控(charge)的区别
...而电荷是根据原子中电子和质子的总数来确定的。 元素周期表中的不同元素表现出不同的化学和物理特性。当它们结合形成分子时,不同的元素以不同的比例与其他元素结合。在元素之间的大量变化中,最简单和重要的参数是...
- 发布于 2020-10-15 23:21
- 阅读 ( 375 )
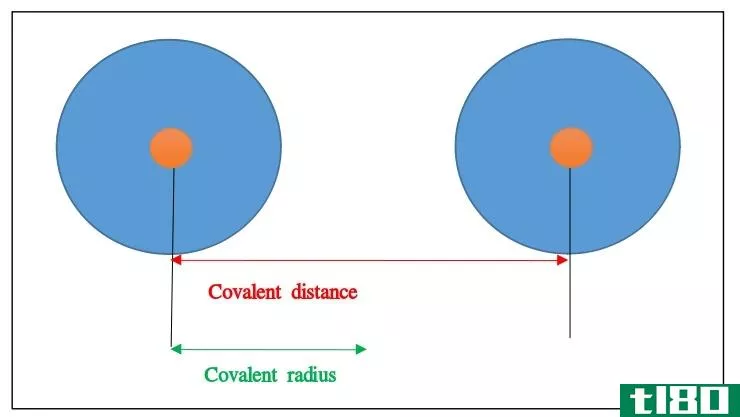
共价半径(covalent radius)和金属半径(metallic radius)的区别
...于金属离子的性质和它们所处的环境。此外,金属半径沿周期表的周期减小。这是由于有效核电荷的增加。此外,在周期表中,金属的半径随着一个群的增加而增加,因为主量子数随着一个群的增加而增加。 共价半径(covalent radi...
- 发布于 2020-10-16 21:04
- 阅读 ( 745 )
酸度(acidity)和碱度(basicity)的区别
...比低负性原子更容易释放,从而产生更高的酸度。在元素周期表中,当一个基团向下移动时,酸度会增加。这是因为原子的尺寸随着原子群的增加而增加。大原子可以稳定负电荷(通过电荷分布);因此与大原子相关的氢离子可...
- 发布于 2020-10-19 11:23
- 阅读 ( 381 )
时期(periods)和组(groups)的区别
化学元素周期表中周期和组的关键区别在于周期是水平行,而组是垂直列。元素周期表中有7个主要周期和18个组。 元素周期表是一个大表,其中每一个已知的化学元素都放在一个考虑到原子结构的特定位置。因此,与任何网...
- 发布于 2020-10-22 03:56
- 阅读 ( 332 )
门捷列夫(mendeleev)和现代元素周期表(modern periodic table)的区别
门捷列夫周期表与现代周期表的关键区别在于,现代周期表的基础主要是元素的电子构型,我们称之为原子序数,而在门捷列夫周期表中,它是元素的原子质量。 让我们看看什么是门捷列夫周期表和什么是现代周期表,然后...
- 发布于 2020-11-03 03:51
- 阅读 ( 230 )
时期(periods)和组(groups)的区别
周期和群是古代化学家用来将标志性的周期表组织成列和行的两个重要分类。句点是水平行,而组(也称为族)是垂直列。根据某些特征,如基团的化学/物理性质和周期的电子构型,将元素排列成基团和周期。文章进一步揭示...
- 发布于 2021-06-25 20:23
- 阅读 ( 513 )
门捷列夫(mendeleev)和现代周期表(modern periodic table)的区别
... 门捷列夫的主要区别(main difference mendeleev) vs. 现代周期表(modern periodic table) 元素周期表是化学元素按其化学和物理性质排列的表。现代元素周期表是在一系列不同版本的元素周期表之后产生的。俄罗斯化学家/教授德米特...
- 发布于 2021-06-27 12:49
- 阅读 ( 225 )
原子半径(atomic radius)和离子半径(ionic radius)的区别
...原子的半径。 覆盖的关键领域 1.什么是原子半径-定义,周期表中的趋势2.什么是离子半径-定义,周期表中的趋势3.原子半径和离子半径之间的区别是什么-主要区别的比较 Key Terms: Atomic Radius, Atoms, Electron Shell, Ionic Radius, I*** 什么...
- 发布于 2021-06-29 14:30
- 阅读 ( 975 )