化学中的aufbau原理简介
使用aufbau原理

使用Aufbau原理计算原子轨道的填充顺序,最糟糕的方法可能是尝试用蛮力记住顺序:
- 1s2s2p3p4s3d4p6s4f5d6p7s5f6d7p8s
幸运的是,有一种更简单的方法可以获得此订单:
- 写一列从1到8的s轨道。
- 从n=2开始,为p轨道写第二列。(1p不是量子力学允许的轨道组合。)
- 从n=3开始为d轨道写一列。
- 为4f和5f写最后一列。没有需要6f或7f外壳填充的元件。
- 从1s开始运行对角线,阅读图表。
此图显示了此表,箭头显示了要遵循的路径。既然你知道了轨道的填充顺序,你只需要记住每个轨道的大小。
- S轨道有一个可能的m值来容纳两个电子。
- P轨道有三个可能的m值来容纳六个电子。
- D轨道有五个可能的m值来容纳10个电子。
- F轨道有七个可能的m值来容纳14个电子。
这就是确定元素的稳定原子的电子构型所需要的全部。
例如,以氮元素为例,它有七个质子和七个电子。第一个要填充的轨道是1s轨道。s轨道上有两个电子,所以剩下五个电子。下一个轨道是2s轨道,并容纳下两个轨道。最后三个电子将进入2p轨道,该轨道最多可容纳六个电子。

硅电子组态实例问题

这是一个工作示例问题,显示了使用前几节中学习的原理确定元件电子配置所需的步骤
问题
确定硅的电子构型。
解决方案
硅是14号元素。它有14个质子和14个电子。原子的最低能级首先被填满。图中的箭头显示了s量子数,自旋向上和自旋向下。
- 步骤A显示前两个电子填满1s轨道,留下12个电子。
- 步骤B显示了接下来的两个电子填充2s轨道,留下10个电子。(2p轨道是下一个可用能级,可以容纳六个电子。)
- 步骤C显示这六个电子,留下四个电子。
- 步骤D用两个电子填充下一个最低能级3s。
- 步骤E显示剩余的两个电子开始填充3p轨道。
Aufbau原理的规则之一是,在相反的自旋开始出现之前,轨道被一种自旋填充。在这种情况下,两个自旋向上电子被放置在前两个空槽中,但实际顺序是任意的。它可能是第二个和第三个插槽,也可能是第一个和第三个插槽。
答复
硅的电子结构为:
1s2.2s2.P6.3秒2.3p2.aufbau主体的符号和例外

电子组态周期表上的符号使用以下形式:
NoE- n是能级
- O是轨道类型(s、p、d或f)
- e是轨道壳中的电子数。
例如,氧有八个质子和八个电子。Aufbau原理认为前两个电子将填满1s轨道。接下来的两个将填满2s轨道,剩下的四个电子将占据2p轨道上的点。这将写为:
1s2.2s2.P4.惰性气体是完全填满其最大轨道且没有剩余电子的元素。氖用其最后六个电子填充2p轨道,并被写为:
1s2.2s2.P6.下一个元素钠在3s轨道上与另一个电子相同。而不是写:
1s2.2s2.P4.3秒1.在一长排重复文本中,使用速记符号:
[Ne]3s1.每个周期将使用前一周期惰性气体的符号。Aufbau原理适用于几乎所有测试元素。这一原理有两个例外,铬和铜。
铬是24号元素,根据Aufbau原理,电子组态应为[Ar]3d4s2。实际实验数据表明该值为[Ar]3d5s1。铜为29号元素,应为[Ar]3d92s2,但已确定为[Ar]3d104s1。
图表显示了周期表的趋势和该元素的最高能量轨道。这是检查计算结果的好方法。另一种检查方法是使用包含此信息的周期表。
- 发表于 2021-09-25 11:14
- 阅读 ( 232 )
- 分类:科学
你可能感兴趣的文章
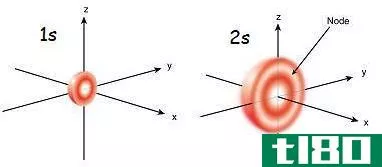
1秒(1s)和2s轨道(2s orbital)的区别
...具有更高的能级。 参考文献:1。歌词。“原子轨道”,化学剧本。歌词,2015年11月3日。网状物。2017年5月26日。<https://chem.libretexts.org/Core/Physical_and_theory_Chemistry/Electronic_Structure of_Atoms_and_Molecules/Atomic_轨道>。2。原...
- 发布于 2020-10-25 04:49
- 阅读 ( 587 )
结合(bonding)和反键分子轨道(antibonding molecular orbitals)的区别
成键与反键分子轨道 这两种分子轨道间的化学键可以用化学键和分子轨道键的不同来解释。键和反键分子轨道之间最显著的区别是它们相对于母原子轨道的能级。这种能级差异导致了两个分子轨道之间的其他差异。 成键和反...
- 发布于 2020-10-26 19:13
- 阅读 ( 648 )
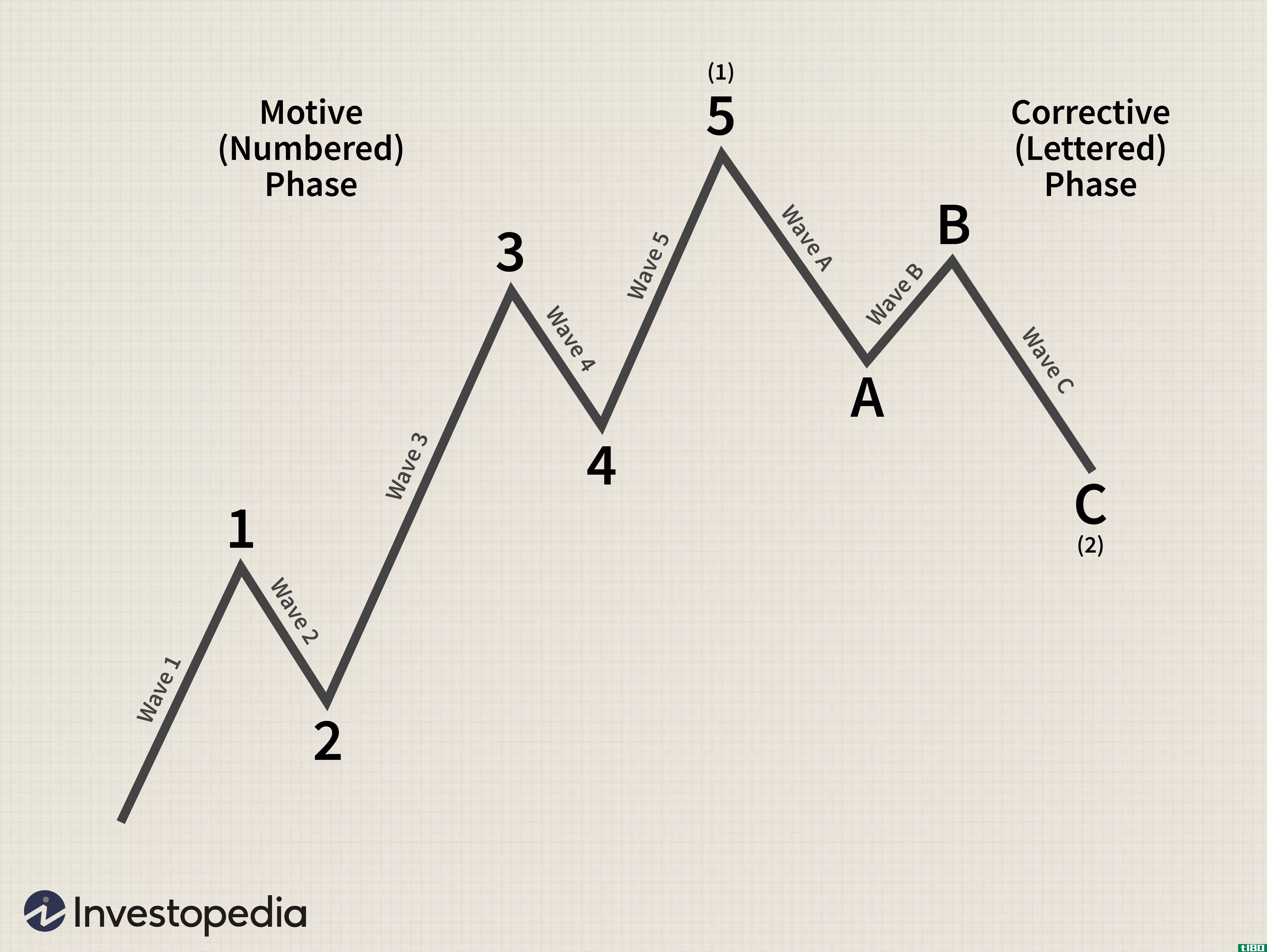
埃利奥特波理论简介
...(A和C)移动,另一种是向主要修正方向移动(B)。上图中的第2波和第4波是修正。这些波通常具有以下结构: 请注意,在这幅图中,A波和C波以一个较大的角度沿趋势方向移动,因此是脉冲波,由五个波组成。相反,B波是...
- 发布于 2021-06-15 09:21
- 阅读 ( 255 )
氧化数(oxidation number)和配价(valency)的区别
...物中心的过渡金属原子组成。这种金属原子被称为配体的化学基团所包围。这些配体具有孤电子对,可以与金属原子共用,形成配位键。配位键形成后,类似于共价键。这是因为配位键中的两个原子共享一对电子,就像共价键一...
- 发布于 2021-06-29 08:42
- 阅读 ( 450 )
d块元素(d block elements)和过渡元素(transition elements)的区别
...过渡元素 什么是d块元素(d block elements)? D块元素是一种化学元素,其电子填充到其D轨道上。对于一个d块单元,第一个要求是d轨道的存在。在d轨道上至少有一个电子的元素被归类为d块元素。周期表的d块位于s块和p块之间。 关...
- 发布于 2021-06-29 08:48
- 阅读 ( 706 )
aufbau原理(aufbau principle)和洪德法则(hund’s rule)的区别
...7月21日。这里有。2017年8月2日。 2.“匈奴人的规则。”化学剧本。Libretexts,2016年7月21日,网络。这里有。2017年8月2日。2.“匈奴人的规则。”化学剧本。Libretexts,2016年7月21日,网络。
- 发布于 2021-06-29 09:52
- 阅读 ( 833 )
d(d)和f块元素(f block elements)的区别
主要差异d(main difference d) vs. f块元素(f block elements) 化学元素是任何不能用化学方法分解或改变的物质。已知的化学元素有118种。这些化学元素是物质的组成部分。所有化学元素都按原子序数递增的顺序排列在元素周期表中。周...
- 发布于 2021-06-29 23:23
- 阅读 ( 462 )
免疫印迹(immunoblot)和蛋白质印迹(western blot)的区别
...蛋白质的分离、电泳转移、抗体检测3。免疫印迹在生物化学和临床应用中有哪些应用。什么是Western Blot?简要描述 关键术语 蛋白质检测,免疫印迹,一级抗体,二级抗体,Western印迹 什么是免疫印迹(immunoblot)? 免疫印迹是分子...
- 发布于 2021-07-02 04:45
- 阅读 ( 444 )
主动免疫和被动免疫简介
...体都有效。例如物理屏障,如粘液、鼻毛、睫毛和纤毛。化学屏障也是一种非特异性防御。化学屏障包括皮肤和胃液的低酸碱度值、眼泪中的溶菌酶、阴道的碱性环境和耳垢。 特定防御:这条防御线对特定的威胁是积极的,例...
- 发布于 2021-09-04 03:10
- 阅读 ( 252 )
气相色谱法-它是什么及其工作原理
...。 哈里斯,丹尼尔C.(1999)。“24.气相色谱法”。定量化学分析(第五版)。弗里曼公司。第675-712页。ISBN 0-7167-2881-8。 Higson,S.(2004年)。分析化学。牛津大学出版社。ISBN 978-0-19-850289-0
- 发布于 2021-09-10 13:34
- 阅读 ( 233 )