非极性(non-polar)和极性共价键(polar covalent bonds)的区别
有三种极性和两种共价键。这三种类型是-极性,非极性和离子。它们是根据化学键之间的作用力分类的,化学键允许两种特定元素相互吸引。元素能形成的共价键的数目由元素价壳层中电子的空位数决定。
非极性(nonpolar) vs. 极性共价键(polar covalent bonds)
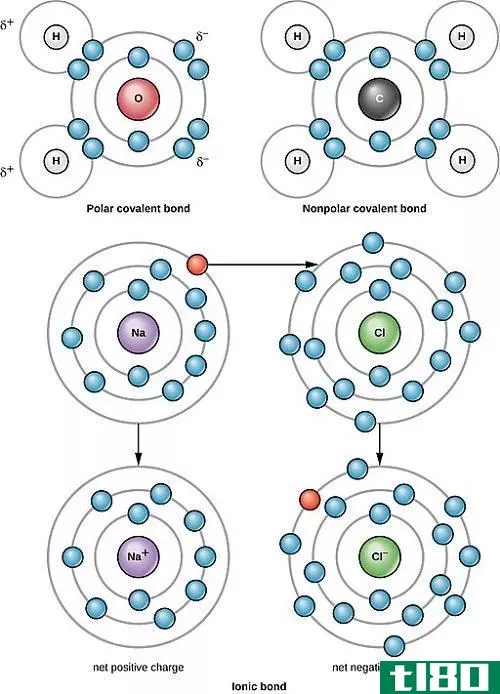
非极性共价键和极性共价键的区别在于,非极性共价键是具有相同电负性的元素之间的键,而极性共价键是具有不同电负性的元素之间的键。

非极性共价键和极性共价键属于共价键的范畴。它们存在于非金属和两种不同类型的元素中。这种分类还说明了两种不同元素中电子的共享和分布,以及它们之间产生的电负性。
当元素结合,一些电子从一种元素转移到另一种元素时,就会形成键。这种转移既可以导致电子的均等共享,也可以导致电子的不均等共享。这些元素之间形成的键的类型由它们之间的电负性差异决定。
| 比较参数 | 非极性共价键 | 极性共价键 |
| 定义 | 非极性共价键是具有相同电负性的元素之间的键。 | 极性共价键是具有不同电负性的元素之间的键。 |
| 电子云 | 这些分子中的电子云没有扭曲。 | 这些分子中的电子云是扭曲的。 |
| 电荷积聚 | 这些元素中没有电荷积累。 | 在这些元素的两极有电荷积聚。 |
| 偶极键 | 非极性共价键没有偶极矩。 | 极性共价键具有偶极矩。 |
| 分子间作用力 | 分子间存在微弱的范德华引力。 | 分子间的吸引力比范德华力更强。 |
| 熔点和沸点 | 这些化合物比极性共价键分子具有更低的熔点和沸点。 | 这些化合物具有较高的熔点和沸点。 |
| 导电 | 这些化合物不导电。 | 这些化合物在水溶液中导电。 |
非极性和极性共价键比较表
什么是非极性共价键(non-polar covalent bond)?
当两个原子平均分享电子时,就会形成一种化学键,称为非极性共价键。这就是为什么这些分子中每个原子共享的电子是相同的。而且,这些原子之间的电负性几乎可以忽略不计。
换句话说,这两个原子都有相似的电负性,而且它们之间没有电荷分离。当共享极性键的原子排列方式使它们之间的电荷相互抵消时,也可以形成这种键。这些类型的键发生在不同的原子或相同的非金属原子之间。
什么是极性共价键(polar covalent bond)?
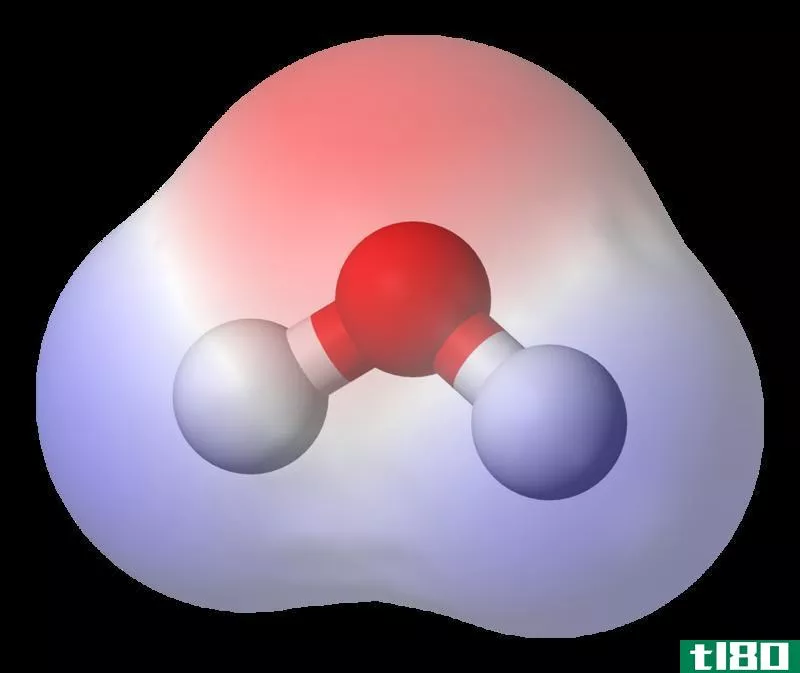
电子分布不均匀的两个原子之间形成的键称为极性共价键。极性共价键可以说是离子键和纯共价键形成的分界线。因此,在这些分子中,始终存在一个电偶极矩,两端相对为负或正。
它们通常形成于两个具有不同电负性的非金属原子之间。由于存在更大的相互作用力,具有这种键的化合物可以作为固体存在。而且,这些化合物的熔点和沸点都很高。如果溶解在水溶液中,它们可以导电。这些化合物易溶于水等极性溶剂。
非极性和极性共价键的主要区别
- 非极性共价键是元素之间具有相同电负性的键,而极性共价键是元素之间具有不同电负性的键。
- 非极性共价键之间的范德华引力较弱,而极性共价键之间的范德华引力较强。
- 非极性共价键分子中的电子云没有畸变,而极性共价键分子中的电子云是畸变的。
- 非极性共价键化合物比极性共价键分子具有更低的熔点和沸点。
- 非极性共价键化合物不导电,而极性共价键分子在水溶液中可以导电。
- 非极性共价键分子没有偶极矩,而极性共价键分子有偶极矩。
- 在非极性共价键分子中不存在电荷积累,而在极性共价键分子中存在极性电荷积累。
结论
非极性共价键和极性共价键都是共价键的一种。主要区别在于它们形成所需的原子。当电子在两个原子之间平均分配时,形成非极性共价键,而当电子在两个原子之间不均匀分布时,形成极性共价键。非极性共价键之间的范德华引力较弱。
极性共价键比范德华力更强,比如氢键和它们之间的其他力。极性共价键化合物也比非极性共价键化合物具有更高的熔点和沸点,这是由于分子原子间的吸引力更大。非极性共价键发生在不同的原子之间,甚至在非金属的相同原子中。
极性共价键通常在两个具有不同电负性的非金属原子之间形成。此外,极性共价键化合物由于其原子的高迁移率,可以在水溶液中导电,而非极性共价键化合物在任何状态下都不能导电。
参考文献
- https://pubs.rsc.org/en/content/articlehtml/1994/p2/p29940002149
- https://www.sciencedirect.com/science/article/pii/S0022283602004655
- 发表于 2021-07-10 04:52
- 阅读 ( 1003 )
- 分类:科学
你可能感兴趣的文章
盐桥(salt bridge)和氢键(hydrogen bond)的区别
...种微弱的吸引力。但是,与其他类型的分子内作用力(如极性相互作用、非极性非极性相互作用(如范德瓦尔力)相比,氢键的强度更大。 Usually, hydrogen bonds form between polar covalent molecules. These molecules contain polar covalent bonds, which f...
- 发布于 2020-10-14 03:27
- 阅读 ( 975 )
共价键(covalent bond)和与格键(dative bond)的区别
共价键和与格键的关键区别在于,当两个原子的未成对电子相互结合时,共价键就形成了;而与格键则是当一个原子将它的一对电子捐赠给另一个原子时形成的。 虽然与格键看起来像共价键,但当我们考虑键的形成时,它们...
- 发布于 2020-10-17 17:57
- 阅读 ( 849 )
共价(covalent)和非共价债券(noncovalent bonds)的区别
共价键和非共价键的关键区别在于,当两个原子共享它们的电子时,共价键就形成了,而非共价键则是通过两个原子之间完全交换电子或不交换任何电子而形成的。 化学键主要有四种类型:共价键、离子键、氢键和范德华相...
- 发布于 2020-10-23 12:39
- 阅读 ( 462 )
离子型(ionic)和共价键(covalent bonds)的区别
离子键和共价键之间的关键区别在于,离子键发生在电负性非常不同的原子之间,而共价键发生在电负性差异相似或极低的原子之间。 正如美国化学家G.N.Lewis提出的那样,当原子的价壳层中含有8个电子时,原子是稳定的。...
- 发布于 2020-11-05 20:46
- 阅读 ( 469 )
极地的(polar)和非极性(non-polar)的区别
极性与非极性 当我们第一次了解化学时,我们大多数人都觉得它有趣而令人兴奋。但是当你只研究化学性质,化学键,元素表等等的时候,你会觉得很无聊。我们在记忆不同的属性,不同的过程,以及更多的东西时会感到沮丧...
- 发布于 2021-06-23 19:30
- 阅读 ( 402 )
非极性(non-polar)和极性共价键(polar covalent bonds)的区别
非极性与极性共价键 非极性和极性共价键既属于极性的三类,也属于共价键的两类。所有这三种类型(离子、极性和非极性)都被归类为化学键,其中有一种力(电负性)允许两种特定元素的原子相互吸引。可能的共价键的数...
- 发布于 2021-06-24 05:05
- 阅读 ( 610 )
极地的(polar)和非极性键(nonpolar bonds)的区别
... Water molecule (negative charge is shaded in red.) 什么是非极性键(non-polar bonds)? 当两种元素的电负性相同时,它们之间会形成共价键。因此,通常当参与键的原子相似时,就会产生非极性键。这类化合物被称为“双原子化合物”。在这...
- 发布于 2021-06-27 10:16
- 阅读 ( 404 )
极地的(polar)和非极性分子(nonpolar molecules)的区别
...i***.” LENNTECH. n、 p.,n.d.网站。2017年2月2日。 “Polar vs Non-Polar Molecules: What you Need to Know.” Udemy Blog. n、 p.,n.d.网站。2017年2月2日。 “What are the properties of non-polar molecules? | Socratic.” Socratic.org. n、 p.,n.d.网站。2017年2月2日。 ...
- 发布于 2021-06-28 12:20
- 阅读 ( 1811 )
如何极性分子和非极性分子相互作用(polar and nonpolar molecules interact with each other)
...ule move randomly. When the electr*** are collected towards one end of the non-polar molecule, a slight negative charge is induced at that particular end. It makes the other end of the molecule slightly positive. This leads to a temporary charge separation on the molecule. When another non-polar mol...
- 发布于 2021-06-28 12:27
- 阅读 ( 895 )
共价的(covalent)和配位键(coordinate bond)的区别
共价键的主要区别(main difference covalent bond) vs. 配位键(coordinate bond) 化学键是两个原子通过交换电子而连接在一起。这可以通过共享电子或完全去除电子来实现。化学键总是有一对自旋相反的电子。这个电子对叫做键对。...
- 发布于 2021-06-29 10:35
- 阅读 ( 832 )