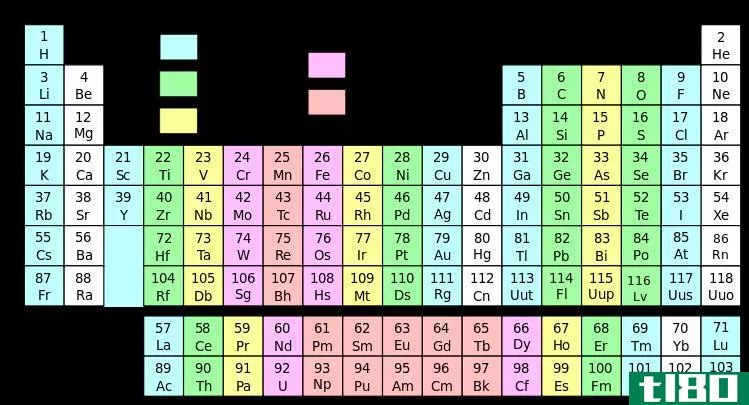
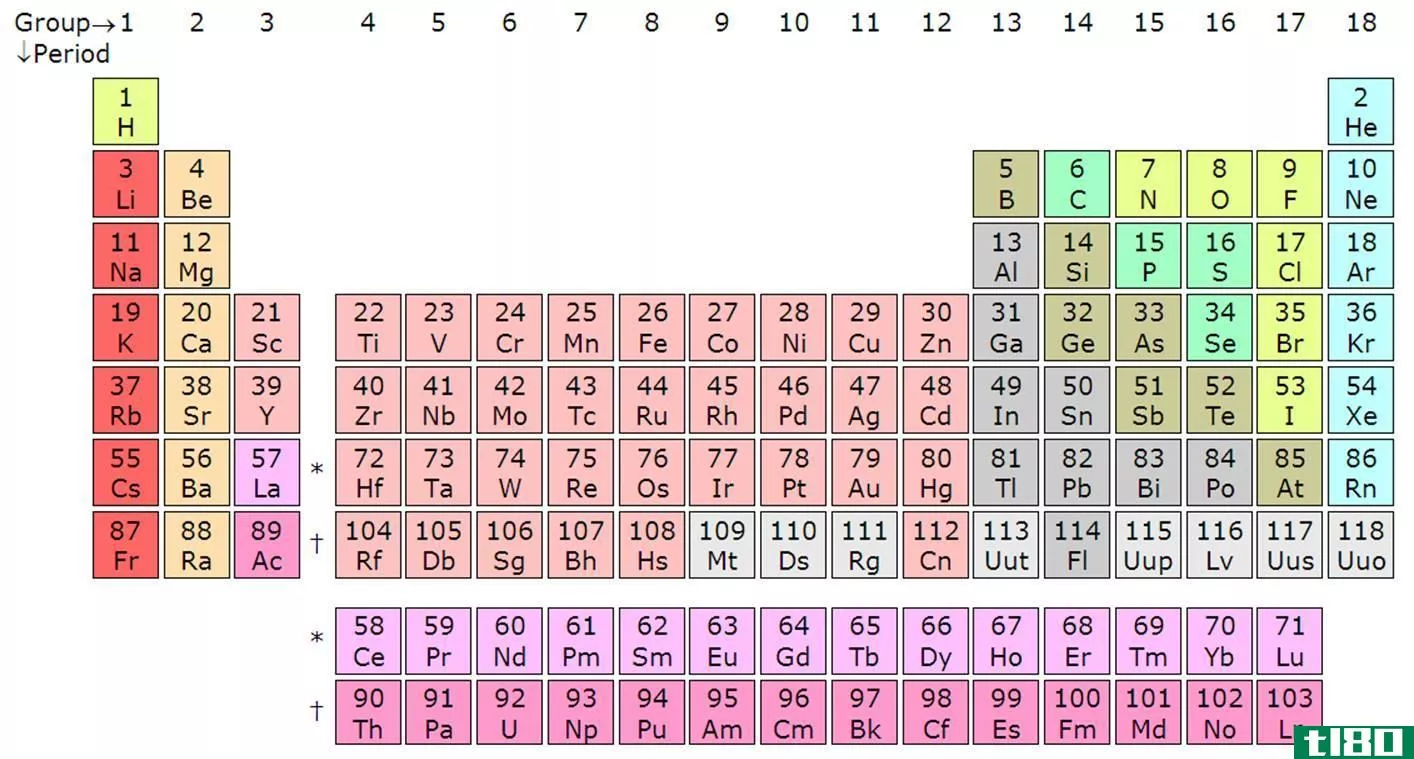
周期表组列表
金属

大多数元素是金属。事实上,许多元素都是金属,有不同的金属组,如碱金属、碱土金属和过渡金属。大多数金属都是有光泽的固体,具有高熔点和高密度。金属的许多特性,包括大原子半径、低电离能和低电负性,都是由于金属原子价壳层中的电子很容易被除去。金属的一个特点是能够变形而不断裂。延展性是金属被锤击成形状的能力。延展性是金属被拉制成金属丝的能力。金属是良好的热导体和电导体。
非金属

非金属元素位于周期表的右上方。非金属与金属之间有一条斜切元素周期表区域的线。非金属具有高电离能和电负性。它们通常是热和电的不良导体。固体非金属通常易碎,几乎没有金属光泽。大多数非金属都有很容易获得电子的能力。非金属显示出广泛的化学性质和反应性。
惰性气体还是惰性气体

惰性气体,也称为惰性气体,位于周期表的第VIII组。惰性气体相对不反应。这是因为它们有一个完整的价壳层。它们几乎没有获得或失去电子的倾向。惰性气体具有高电离能和可忽略的电负性。惰性气体的沸点较低,都是室温下的气体。
卤素

卤素位于周期表的第VIIA族。有时卤素被认为是一组特殊的非金属。这些活性元素有七个价电子。作为一个群体,卤素表现出高度可变的物理性质。卤素在室温下的范围从固体到液体再到气体。化学性质更加均匀。卤素具有很高的电负性。氟在所有元素中具有最高的电负性。卤素与碱金属和碱土特别反应,形成稳定的离子晶体。
半金属或类金属

类金属或半金属位于周期表中金属和非金属之间的直线上。类金属的电负性和电离能介于金属和非金属的电负性和电离能之间,因此类金属表现出两种类型的特征。类金属的反应性取决于它们与之反应的元素。例如,硼在与钠反应时作为非金属,而在与氟反应时作为金属。类金属的沸点、熔点和密度差别很大。类金属的中等导电性意味着它们倾向于制造良好的半导体。
碱金属

碱金属是位于周期表IA族中的元素。碱金属具有许多金属所共有的物理性质,尽管其密度低于其他金属。碱金属的外壳中有一个电子,这是松散结合的。这使它们在各自的周期内拥有最大的元素原子半径。它们的低电离能导致它们的金属性质和高反应性。碱金属很容易失去其价电子而形成一价阳离子。碱金属的电负性很低。它们很容易与非金属,特别是卤素发生反应。
碱土

碱土是元素周期表第IIA族中的元素。碱土金属具有许多金属的特性。碱土金属具有低电子亲合性和低电负性。与碱金属一样,其性质取决于电子丢失的难易程度。碱土金属的外层有两个电子。它们的原子半径比碱金属小。这两个价电子与原子核没有紧密的结合,因此碱土金属很容易失去电子而形成二价阳离子。
基本金属

金属是优良的电导体和热导体,具有高光泽和高密度,具有延展性和延展性。
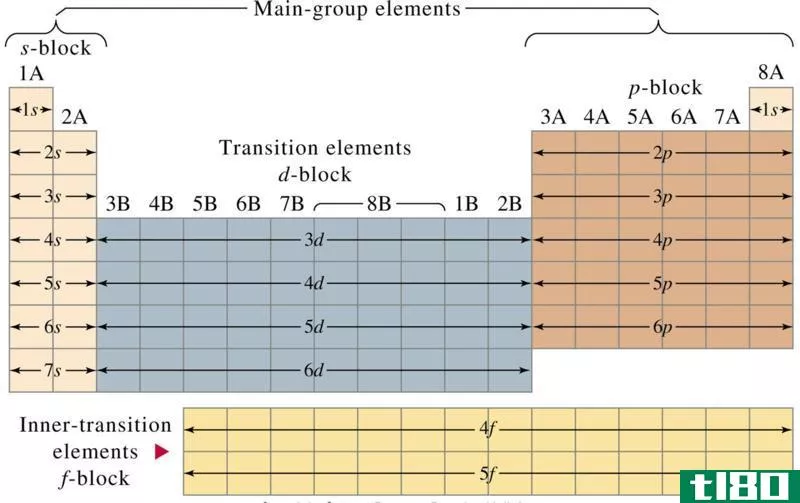
过渡金属

过渡金属位于周期表的IB至VIIIB族中。这些元素非常坚硬,熔点和沸点都很高。过渡金属具有较高的导电性和延展性以及较低的电离能。它们表现出广泛的氧化状态或带正电的形式。正氧化状态允许过渡元素形成许多不同的离子和部分离子化合物。络合物形成特征性的有色溶液和化合物。络合反应有时会增强某些化合物相对较低的溶解度。
稀土

稀土是元素周期表主体下方两行元素中的金属。稀土有两块,镧系和锕系。在某种程度上,稀土是特殊的过渡金属,具有这些元素的许多特性。
镧系元素

镧系元素是位于周期表第5d区的金属。第一个5d过渡元素是镧或镥,这取决于您如何解释元素的周期性趋势。有时,只有镧系元素而不是锕系元素被归类为稀土。一些镧系元素是在铀和钚的裂变过程中形成的。
锕系元素

锕系元素的电子构型利用f亚级。根据您对元素周期性的解释,该系列以锕、钍甚至镧开始。所有锕系元素都是高电正性的高密度放射性金属。它们在空气中容易变色,并与大多数非金属结合。
- 发表于 2021-09-15 13:17
- 阅读 ( 277 )
- 分类:化学
你可能感兴趣的文章
第1组(group 1)和第2组元素(group 2 elements)的区别
...对的电子,而第2组元素的最外层轨道上都有成对电子。 周期表的第1组和第2组包含s块元素。这意味着,这些元素的最外层电子在s轨道上。第1组和第2组的区别取决于它们最外层轨道上的电子数。一个s轨道只能包含两个电子,因...
- 发布于 2020-10-15 03:15
- 阅读 ( 956 )
代表(representative)和过渡元素(transition elements)的区别
关键区别——代表性要素与过渡要素 元素周期表是以原子序数为基础的所有已知化学元素的列表排列。周期表中有行或句点、列或组。元素周期表中有周期性的趋势。周期表中的元素可分为代表元素和过渡元素两类。代表元...
- 发布于 2020-10-19 10:23
- 阅读 ( 761 )
时期(periods)和组(groups)的区别
周期和群是古代化学家用来将标志性的周期表组织成列和行的两个重要分类。句点是水平行,而组(也称为族)是垂直列。根据某些特征,如基团的化学/物理性质和周期的电子构型,将元素排列成基团和周期。文章进一步揭示...
- 发布于 2021-06-25 20:23
- 阅读 ( 513 )
期间(period)和组(group)的区别
化学元素周期表是学生们被要求死记硬背的东西,他们甚至不知道学习它的真正动机。对有些人来说,这只是一个包含在教学大纲中的话题。但在真正意义上,这个小小的元素周期表远比它重要,它是一个为全世界科学家和研究...
- 发布于 2021-07-09 21:13
- 阅读 ( 283 )
为什么镧系元素和锕系元素在元素周期表上是分开的
镧系元素和锕系元素与元素周期表的其余部分分开,通常在底部显示为单独的行。这种放置的原因与这些元素的电子构型有关。 3b元素组 当你看元素周期表时,你会在3B元素组中看到奇怪的条目。3B组标志着过渡金属元素的...
- 发布于 2021-09-15 10:51
- 阅读 ( 425 )
周期表研究指南-介绍与历史
周期表导言 自古以来,人们就知道碳和金等元素。这些元素不能用任何化学方法改变。每种元素都有唯一数量的质子。如果你检查铁和银的样品,你就不知道原子中有多少质子。但是,您可以区分这些元素,因为它们具有不...
- 发布于 2021-09-15 11:38
- 阅读 ( 201 )
周期表组列表
...好的热导体和电导体。 非金属 非金属元素位于周期表的右上方。非金属与金属之间有一条斜切元素周期表区域的线。非金属具有高电离能和电负性。它们通常是热和电的不良导体。固体非金属通常易碎,几乎没有金属...
- 发布于 2021-09-15 13:17
- 阅读 ( 277 )
过渡金属:列表和属性
周期表上最大的元素组是过渡金属,在表中间发现。此外,周期表主体下方的两行元素(镧系元素和锕系元素)是这些金属的特殊子集。这些元素被称为“过渡金属”,因为它们的原子的电子转变为填充d亚壳层或d亚能级轨道。...
- 发布于 2021-09-15 13:20
- 阅读 ( 265 )
属于基本金属组的元素列表
元素周期表上有几个元素组被认为是金属。这是基本金属元素的列表。 元素13-铝 元素31-镓 元素49-铟 元素50-锡 元素81-铊 元素82-铅 元素83-铋 元素113——非中心元素——可能是一种基本金属。 114号元素——氟里昂——可能是...
- 发布于 2021-09-15 13:24
- 阅读 ( 186 )
化学中的周期表定义
元素周期表是通过增加原子序数对化学元素进行的表格排列,显示元素,以便人们可以看到其性质的趋势。俄国科学家德米特里·门捷列夫(Dmitri Mendeleev)最常被认为是发明了元素周期表(1869年)。现代的元素周期表是从门捷...
- 发布于 2021-09-15 16:56
- 阅读 ( 416 )