化学中的s轨道定义
根据海森堡测不准原理,在任何给定的时刻,在离原子核的任何距离和任何方向都可以找到一个电子。s轨道是一个球形区域,描述在一定概率范围内可以找到电子的位置。轨道的形状取决于与能量状态相关的量子数。所有s轨道的l=m=0,但n的值可以变化。

s轨道与p轨道
虽然轨道数(例如,n=1、2、3)表示电子的能级,但字母(s、p、d、f)表示轨道形状。s轨道是一个围绕原子核的球体。在球体中有一些壳层,在任何给定的时间内都更可能在其中发现电子。最小的球体是1s。2s轨道大于1s;3s轨道大于2s。
p轨道为哑铃形,并朝向特定方向。在任何一个能级上,都有三个相互成直角的p轨道(px,py,pz)。与s轨道一样,p轨道描述了原子核周围空间中可能发现概率最高的电子的区域。
- 发表于 2021-09-15 18:31
- 阅读 ( 285 )
- 分类:化学
你可能感兴趣的文章
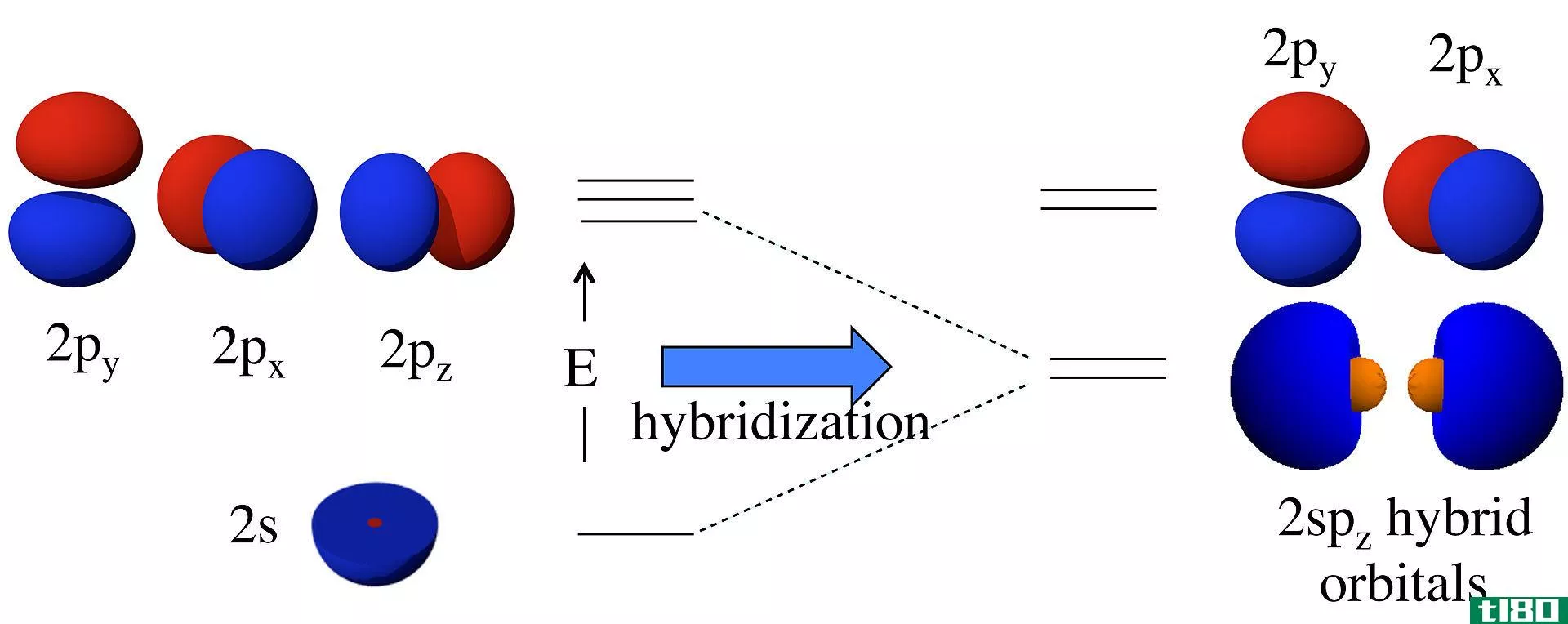
杂交(hybridization)和重叠(overlapping)的区别
...交轨道是通过杂交过程形成的。杂化和重叠是两个相关的化学概念。原子轨道的重叠发生在杂交过程中。 目录 1. 概述和主要区别 2. 什么是杂交 3. 什么是重叠 4. 并列比较-杂交与表格形式的重叠 5. 摘要 什么是杂交(hybridization)? ...
- 发布于 2020-10-15 21:29
- 阅读 ( 501 )
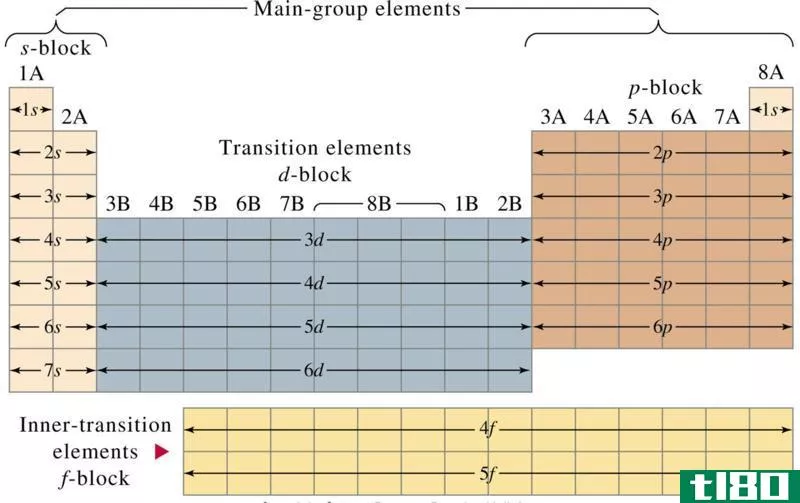
代表(representative)和过渡元素(transition elements)的区别
...与过渡要素 元素周期表是以原子序数为基础的所有已知化学元素的列表排列。周期表中有行或句点、列或组。元素周期表中有周期性的趋势。周期表中的元素可分为代表元素和过渡元素两类。代表元素与过渡元素的主要区别在...
- 发布于 2020-10-19 10:23
- 阅读 ( 768 )
键对(bond pair)和孤独的一对(lone pair)的区别
...语。这些电子对引起化合物的反应性、极性、物理状态和化学性质。离子化合物可能有也可能没有键对和孤对。共价化合物和配合物本质上都有键对。它们可能有也可能没有单独的一对。键对和孤对的区别在于,键对是由键中的...
- 发布于 2021-06-29 09:14
- 阅读 ( 628 )
vsepr公司(vsepr)和价键理论(valence bond theory)的区别
...rence vsepr) vs. 价键理论(valence bond theory) VSEPR和价键理论是化学中用来解释共价化合物性质的两种理论。VSEPR理论解释了分子中原子的空间排列。这个理论利用孤电子对和键电子对之间的排斥作用来预测某个分子的形状。价键理论...
- 发布于 2021-06-29 09:45
- 阅读 ( 686 )
s(s)和p块元素(p block elements)的区别
...这些元素是惰性气体,除非在极端条件下,否则不能发生化学反应。惰性气体具有最稳定的电子构型,它们的p轨道完全充满了电子。第7组元素称为卤素。p嵌段中几乎所有的元素都形成共价化合物,也可以参与离子键的形成。 s(...
- 发布于 2021-06-29 09:51
- 阅读 ( 539 )
aufbau原理(aufbau principle)和洪德法则(hund’s rule)的区别
...7月21日。这里有。2017年8月2日。 2.“匈奴人的规则。”化学剧本。Libretexts,2016年7月21日,网络。这里有。2017年8月2日。2.“匈奴人的规则。”化学剧本。Libretexts,2016年7月21日,网络。
- 发布于 2021-06-29 09:52
- 阅读 ( 832 )
价键理论(valence bond theory)和分子轨道理论(molecular orbital theory)的区别
...些轨道以不同的方式排列。这些轨道的排列将决定分子的化学键和形状或几何。为了解释这些轨道的排列,我们可以使用价键理论或分子轨道理论。价键理论与分子轨道理论的主要区别在于价键理论解释了轨道的杂化,而分子轨...
- 发布于 2021-06-29 10:32
- 阅读 ( 407 )
杂化轨道(hybrid orbitals)和分子轨道(molecular orbitals)的区别
...键。换句话说,一个原子的原子轨道经过杂化,形成适合化学键的轨道。原子轨道有s轨道、p轨道、d轨道和f轨道。两个或更多轨道的杂化将形成一个新的杂化轨道。杂化轨道是根据经过杂化的原子轨道命名的。下面给出一些例...
- 发布于 2021-06-29 11:00
- 阅读 ( 511 )
轨道(orbitals)和能级(energy levels)的区别
...道。这个分子轨道表明共价键的形成。因此,轨道直接与化学键有关。 什么是能级(energy levels)? 位于原子核周围的电子壳层称为能级。这些壳具有离散的能量值。电子充满这些能级或壳层。这些能级被命名为K、L、M、N等。能量...
- 发布于 2021-06-29 11:11
- 阅读 ( 395 )
壳次壳(shell subshell)和轨道(orbital)的区别
...同能级但自旋不同的电子组成。 引用 1.安德鲁·雷德。”化学基础,这里提供。查阅日期:2017年8月25日。2.“GCSE Bitesize:原子的结构”,BBC,BBC,可在此处查阅。查阅日期:2017年8月25日。2.《普通中等教育证书:原子的结构》,...
- 发布于 2021-06-29 12:03
- 阅读 ( 1239 )