sp sp2型(sp sp2)和sp3杂交(sp3 hybridization)的区别
主要差异sp(main difference sp) vs. sp2级(sp2)
轨道是可以充满电子的假设结构。根据不同的发现,科学家们已经为这些轨道提出了不同的形状。轨道有三种主要类型:原子轨道、分子轨道和混合轨道。原子的原子轨道经过杂交,使其成为适合化学键合的轨道。在化学中,杂化是指不同原子轨道的混合,形成混合轨道。由于杂交的形式不同,使得sp、sp2和sp3杂化轨道的形式不同。这些轨道是由不同比例的s和p原子轨道杂交而成。spsp2与sp3杂交的主要区别在于sp杂交形成具有50%s轨道特征的杂交轨道,sp2杂化形成具有33%s轨道特征的杂化轨道,sp3杂化形成具有25%s轨道特征的杂化轨道。
覆盖的关键领域
1.sp杂交是什么?定义、S和P特性计算、其他特征2.sp2杂交是什么?定义、S和P特性计算、其他特征3.sp3杂交——定义、S和P特性计算,其他特征4.sp sp2和sp3杂交有什么区别——关键差异比较
关键词:原子轨道,杂化轨道,杂化,轨道,Sp杂化,Sp2杂化,Sp3杂化

什么是sp杂交(sp hybridization)?
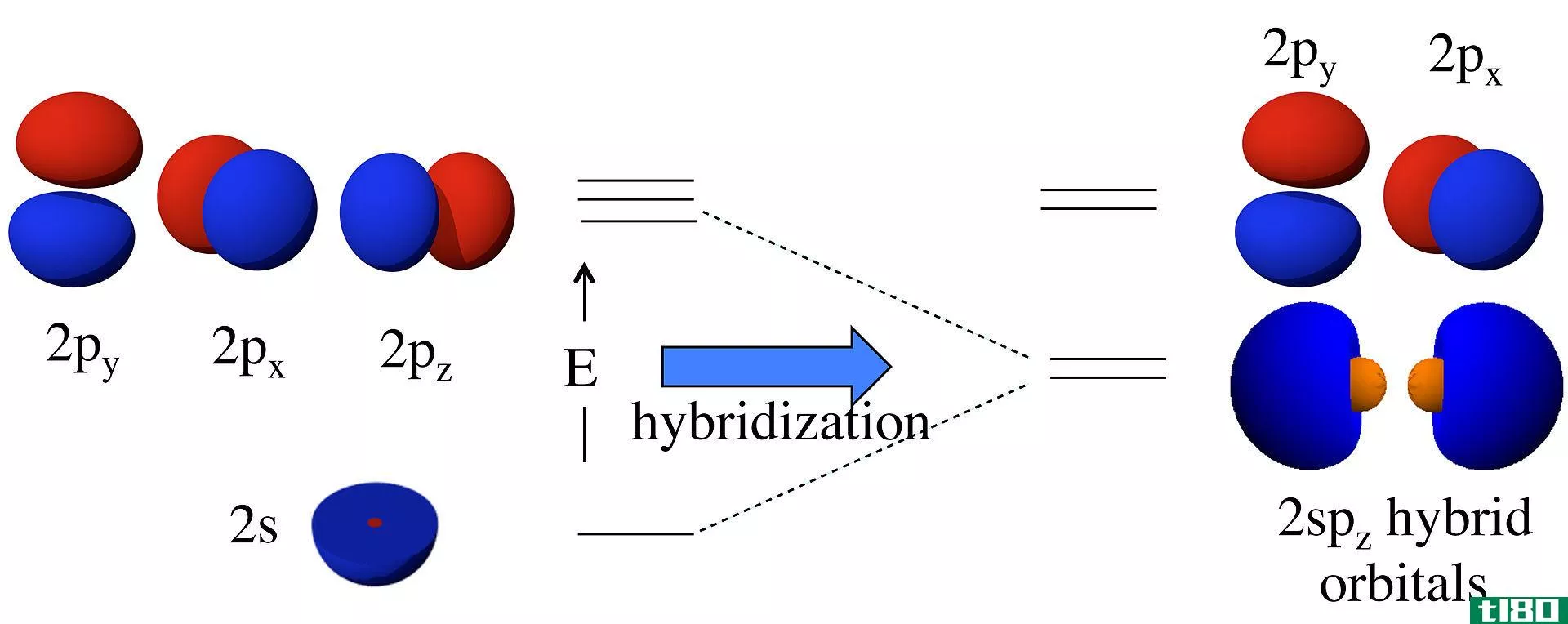
sp杂化是发生在s原子轨道和p原子轨道之间的杂化。一个电子壳层包含三个p轨道。因此,在s轨道与其中一个p轨道杂交后,该原子中存在两个未杂交的p轨道。这里,我们认为所有的s和p轨道都是原子轨道(s+p)。s轨道与p轨道的比值为1:1,因此s轨道的分数为1/2,p轨道的分数为1/2。
S(或p)特征百分比=总原子轨道x(1/2)x 100%=50%

Figure 1: sp Hybridization
得到的杂化轨道具有50%的s特性和50%的p特性。由于只形成了两个杂化轨道,sp轨道的空间排列是线性的。这两个杂化轨道指向相反的方向。因此,这些轨道之间的夹角是180度。
什么是sp2杂交(sp2 hybridization)?
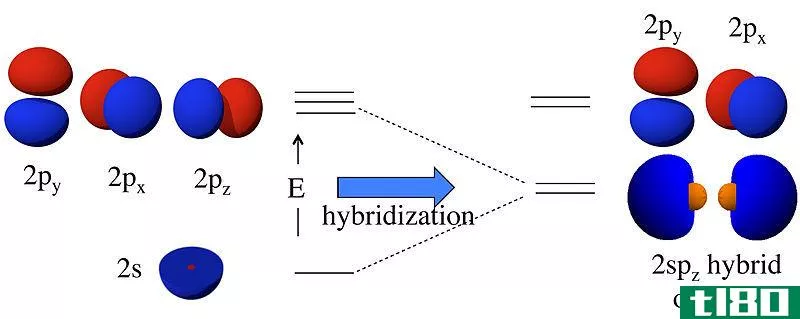
sp2杂化是一个s原子轨道和两个p原子轨道的混合。新形成的杂化轨道称为sp2杂化轨道。得到的杂化轨道具有约33.33%的s特征和约66.66%的p特征。这是因为共有三个原子轨道参与杂化,s和p特征的百分比变化如下。
这里,我们认为所有的s和p轨道都是原子轨道(s+p+p)。s轨道与p轨道的比值为1:2,因此s轨道的分数为1/3,p轨道的分数为2/3。
S特征百分比=总原子轨道x(1/3)x 100%=33.33%P特征百分比=总原子轨道x(2/3)x 100%=66.66%

Figure 2: sp2杂交
sp2杂化轨道的空间排列是三角平面的。因此,这些轨道之间的夹角是120度。经过这种杂化的原子有一个未杂化的p轨道,因为三个p轨道中只有两个参与了这种杂化。
什么是sp3杂交(sp3 hybridization)?
sp3杂化是一个s原子轨道与三个p原子轨道的混合。在这里,原子没有未杂化的p轨道,因为这三个p轨道都与杂化有关。由此产生的轨道被称为sp3杂化轨道。和sp2轨道一样,我们可以计算这些轨道的s和p特性。
在sp3杂化中,我们认为所有s和p轨道都是原子轨道(s+p+p+p)。s轨道与p轨道的比值为1:3,因此s轨道的分数为¼, p轨道的分数是¾.
S特征百分比=总原子轨道x(1/4)x 100%=25%p特征百分比=总原子轨道x(3/4)x 100%=75%

Figure 3: sp3杂交
当一个s轨道和3p轨道杂交时,这些轨道就形成了。由此产生的杂化轨道具有约25%的s特征和约75%的p特征。这些轨道的空间排列是四面体的。因此,这些轨道之间的夹角是109.5度。
sp sp2型(sp sp2)和sp3杂交(sp3 hybridization)的区别
定义
sp杂化:sp杂化是发生在s原子轨道和p原子轨道之间的杂化。
sp2杂交:sp2杂交是一个s原子轨道与两个p原子轨道的混合。
sp3杂交:sp3杂交是一个s原子轨道与三个p原子轨道的混合。
s特性
sp杂化:sp杂化轨道的s特征百分率为50%。
sp2杂化:sp2杂化轨道的s特征百分率为33.33%。
sp3杂化:sp3杂化轨道的s特征百分率为25%。
p杂化轨道的特征百分比
sp杂化:sp杂化轨道的p特征百分率为50%。
sp2杂化:sp2杂化轨道的p特征百分率为66.66%。
sp3杂化:sp3杂化轨道的p特征百分率为75%。
轨道夹角
sp杂化:sp轨道之间的夹角是180°C.
sp2杂化:sp2轨道之间的夹角是120°C.
sp3杂化:sp3轨道间的夹角为109.5°C.
几何学
sp杂化:sp杂化中轨道排列的几何形状是线性的。
sp2杂化:sp2杂化中轨道排列的几何形状是三角平面的。
sp3杂化:sp3杂化中轨道排列的几何形状为四面体。
未杂交轨道数
sp杂交:sp杂交产生两个未杂交的p轨道。
sp2杂交:sp2杂交产生一个未杂交的p轨道。
sp3杂交:sp3杂交不会产生任何未杂交的p轨道。
结论
化学杂化是指不同原子轨道的混合,形成具有不同特征的新的杂化轨道。Sp、sp2和sp3杂交就是这样的例子。sp、sp2和sp3杂交的主要区别在于sp杂交形成具有50%s轨道特征的杂交轨道,sp2杂化形成具有33%s轨道特征的杂化轨道,sp3杂化形成具有25%s轨道特征的杂化轨道。
引用
1. “混合轨道。“化学剧本,剧本,2016年7月21日,可在这里获得。2。”轨道杂交〉,维基百科,维基媒体基金会,2018年1月15日,可在这里查阅。 2.“轨道杂交”,维基百科,维基媒体基金会,2018年1月15日,
- 发表于 2021-06-30 09:50
- 阅读 ( 796 )
- 分类:科学
你可能感兴趣的文章
双子座的(geminal)和邻二卤化物(vicinal dihalides)的区别
双卤化物和邻卤化物的关键区别在于,双卤化物的两个卤化物基团都附着在同一个碳原子上,而相邻的二卤化物基团则附着在同一化合物中的两个相邻碳原子上。 术语geminal和necinal与具有替代物的化合物一起使用。这些术语...
- 发布于 2020-10-01 09:46
- 阅读 ( 262 )
杂交(hybridization)和重叠(overlapping)的区别
...轨道主要有三种类型:原子轨道、分子轨道和杂化轨道。杂交轨道是通过杂交过程形成的。杂化和重叠是两个相关的化学概念。原子轨道的重叠发生在杂交过程中。 目录 1. 概述和主要区别 2. 什么是杂交 3. 什么是重叠 4. 并列比...
- 发布于 2020-10-15 21:29
- 阅读 ( 501 )
混合的(hybrid)和简并轨道(degenerate orbitals)的区别
...或多个原子轨道组合而成的轨道。我们称这种组合过程为杂交。在这些轨道形成之前,原子轨道可能具有不同的能量,但在形成之后,所有轨道的能量相同。例如,一个s原子轨道和一个p原子轨道可以组合成两个sp轨道。s和p原子...
- 发布于 2020-10-16 17:47
- 阅读 ( 899 )
sp sp2(sp sp2)和sp3级(sp3)的区别
...道具有25%s轨道特性。 术语sp,sp2和sp3,是指轨道的不同杂交导致形成杂化轨道。轨道是一个原子核周围的假想区域,其中包含该原子的电子。这些轨道可以通过杂交形成新的杂化轨道,从而形成共价化学键。根据参与杂交过程...
- 发布于 2020-10-17 11:39
- 阅读 ( 634 )
纯净的(pure)和杂化轨道(hybrid orbitals)的区别
...们要讨论复杂分子中的化学键,我们需要知道什么是轨道杂交。轨道杂化是描述原子轨道混合形成新杂化轨道的化学概念。这些轨道涉及共价化学键的形成。 目录 1. 概述和主要区别 2. 什么是纯轨道 3. 什么是杂化轨道 4. 并列比...
- 发布于 2020-10-17 13:43
- 阅读 ( 559 )
乙醚(ether)和酮(ketone)的区别
乙醚和酮之间的关键区别在于,乙醚含有两个与同一氧原子键合的烷基,而酮则含有一个通过双键与碳原子键结合的氧原子。 醚和酮是有机化合物。这两种化合物的分子结构中都有C,H和O原子。然而,通过测定它们的官能团...
- 发布于 2020-10-18 17:50
- 阅读 ( 520 )
立体中心(stereocenter)和手性中心(chiral center)的区别
...的一个点,不一定是原子。 手性中心是碳原子。 碳的杂交 如果立体中心是碳原子,它可以是sp2杂交或sp3杂交。 手性中心本质上是sp3杂化的。 原子群 立体中心可以有三个或四个组连接到它。 手性中心基本上有四个基团附...
- 发布于 2020-10-18 18:28
- 阅读 ( 1363 )
乙烷乙烯(ethane ethene)和乙炔(ethyne)的区别
乙烷-乙烯和乙炔的主要区别在于乙烷具有sp3杂化碳原子,而乙烯具有sp2杂化碳原子,而乙炔具有sp杂化碳原子。 乙烷、乙烯和乙炔是重要的碳氢化合物,存在于原油和天然气中。所有这些都是气态化合物,因为它们是非常小...
- 发布于 2020-10-18 19:07
- 阅读 ( 1157 )
sp3d2型(sp3d2)和d2sp3杂交(d2sp3 hybridization)的区别
关键区别——sp3d2与d2sp3杂交 在电子所在的原子中有一种被称为轨道的假想结构。不同的科学发现为这些轨道提出了不同的形状。原子轨道可以经历一个称为杂交的过程。为了获得化学键合所需的合适形状,轨道杂交发生了。...
- 发布于 2020-10-19 13:51
- 阅读 ( 723 )
q碳(q carbon)和钻石(diamond)的区别
Q碳与金刚石的主要区别在于Q碳(或淬火碳)具有随机结构,而金刚石具有金刚石立方晶体结构。 碳和金刚石是碳的同素异形体。同素异形体是同一化学元素的不同结构形式。另一种常见的碳同素异形体是石墨。此外,钻石...
- 发布于 2020-10-23 03:18
- 阅读 ( 363 )