什么是元素周期表的各个部分?(the parts of the periodic table?)
元素周期表是化学中最重要的工具。为了充分利用元素周期表,了解元素周期表的各个部分以及如何使用元素周期表预测元素的性质是很有帮助的。


要点:元素周期表的部分内容
- 元素周期表通过增加原子序数对元素进行排序,原子序数是元素原子中的质子数。
- 周期表的行称为周期。一个周期内的所有元素共享相同的最高电子能级。
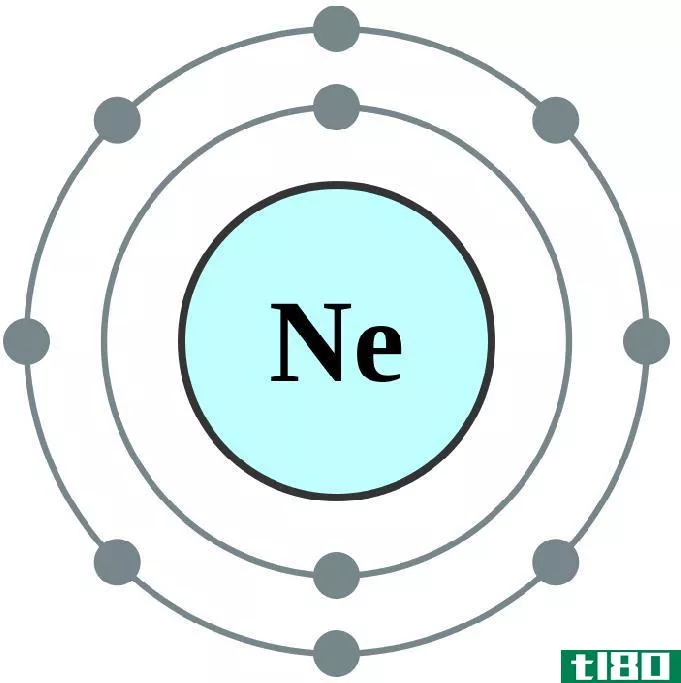
- 周期表的列称为组。一组中的所有元素都有相同数量的价电子。
- 三大类元素是金属、非金属和类金属。大多数元素是金属。非金属元素位于周期表的右侧。类金属具有金属和非金属的特性。
周期表的3个主要部分
元素周期表按原子序数递增的顺序列出了化学元素,原子序数是元素中每个原子的质子数。桌子的形状和元素的排列方式具有重要意义。
每个元素都可以指定为三大元素类别之一:
金属
除氢外,周期表左侧的元素是金属。实际上,氢在固态时也起到金属的作用,但在正常温度和压力下,氢元素是一种气体,在这些条件下不显示金属特征。金属特性包括:
- 金属光泽
- 高导电性和高导热性
- 普通硬固体(汞为液体)
- 通常具有延展性(能够被拉成钢丝)和延展性(能够被锤击成薄片)
- 大多数都有高熔点
- 容易失去电子(电子亲和力低)
- 低电离能
周期表主体下方的两行元素是金属。具体来说,它们是过渡金属的集合,称为镧系和锕系或稀土金属。这些元素位于桌子下面,因为没有一种实用的方法可以将它们插入过渡金属部分而不使桌子看起来很奇怪。
类金属(或半金属)
元素周期表的右边有一条之字形的线,它是金属和非金属之间的边界。这条线两边的元素表现出一些金属和一些非金属的性质。这些元素是类金属,也称为半金属。类金属具有不同的性质,但通常:
- 类金属有多种形式或同素异形体
- 可在特殊条件下导电(半导体)
非金属
元素周期表右边的元素是非金属元素。非金属属性包括:
- 通常是热和电的不良导体
- 通常是室温和压力下的液体或气体
- 缺乏金属光泽
- 容易获得电子(高电子亲和力)
- 高电离能
周期表中的周期和组
元素周期表的排列将具有相关属性的元素组织起来。两个一般类别是组和期间:
元素组组是表的列。一组元素的原子具有相同数量的价电子。这些元素有许多相似的性质,在化学反应中,它们的作用方式往往相同。
元素周期周期表中的行称为周期。这些元素的原子都具有相同的最高电子能级。
形成化合物的化学键
您可以使用元素周期表中元素的组织来预测元素之间如何形成键以形成化合物。
离子键电负性值非常不同的原子之间形成离子键。离子化合物形成含有带正电荷的阳离子和带负电荷的阴离子的晶格。金属和非金属之间形成离子键。因为离子固定在晶格中,所以离子固体不导电。然而,当离子化合物溶解在水中时,带电粒子自由移动,形成导电电解质。
共价键在共价键中共享电子。这种类型的键在非金属原子之间形成。记住,氢也被认为是非金属,所以它与其他非金属形成的化合物具有共价键。
金属键金属也与其他金属键合,在所有受影响的原子周围形成一个电子海,共享价电子。不同金属的原子形成合金,合金具有不同于其组成元素的特性。因为电子可以自由移动,金属很容易导电。
- 发表于 2021-10-14 07:08
- 阅读 ( 322 )
- 分类:数学
你可能感兴趣的文章
钌(ruthenium)和铑(rhodium)的区别
...,而铑在最外层的d电子壳层中包含8个电子。 钌和铑都是周期表第5期的化学元素。但是它们有不同的原子数,因此,这些化学元素具有如下所述的不同的化学和物理性质。 目录 1. 概述和主要区别 2. 什么是钌 3. 什么是铑 4. 并列...
- 发布于 2020-09-19 09:55
- 阅读 ( 661 )
门捷列夫(mendeleev)和莫斯利周期表(moseley periodic table)的区别
关键区别——门捷列夫与莫斯利周期表 元素周期表是所有已知的化学元素在一个表中的排列,代表它们的周期趋势。化学元素是根据原子序数排列的。这些化学元素可以按不同的方式分类:金属、非金属和类金属、s块、p块...
- 发布于 2020-10-16 07:44
- 阅读 ( 585 )
价(valency)和价电子(valence electrons)的区别
...键。在某些原子中,价电子的数目等于价电子的数目。 什么是价电子(valence electr***)? The number of electr*** in the outermost shell of an atom is called “valence electr***”. Because of this reason, the outermost shell of an atom is called “valence shell”. Most of...
- 发布于 2020-10-24 18:09
- 阅读 ( 996 )
门捷列夫(mendeleev)和现代元素周期表(modern periodic table)的区别
门捷列夫周期表与现代周期表的关键区别在于,现代周期表的基础主要是元素的电子构型,我们称之为原子序数,而在门捷列夫周期表中,它是元素的原子质量。 让我们看看什么是门捷列夫周期表和什么是现代周期表,然后...
- 发布于 2020-11-03 03:51
- 阅读 ( 238 )
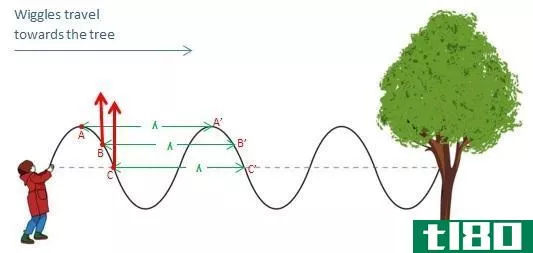
波长(wavelength)和期间(period)的区别
...距离,而周期是在给定点上发生完全振荡所需的时间。 什么是波长(wavelength)? 波由振荡组成。如果你上下摆动绳子的一端,如下图所示,“摆动”沿着绳子移动。为了沿着绳子传输摆动,绳子上的每个粒子都应该上下移动。例...
- 发布于 2021-06-27 09:43
- 阅读 ( 344 )
门捷列夫(mendeleev)和现代周期表(modern periodic table)的区别
... 门捷列夫的主要区别(main difference mendeleev) vs. 现代周期表(modern periodic table) 元素周期表是化学元素按其化学和物理性质排列的表。现代元素周期表是在一系列不同版本的元素周期表之后产生的。俄罗斯化学家/教授德米特...
- 发布于 2021-06-27 12:49
- 阅读 ( 234 )
电负性(electronegativity)和电子亲和力(electron affinity)的区别
...。 电负性取决于原子序数和元素中原子的大小。当考虑周期表时,氟(F)的电负性为4.0,因为它是一个小原子,价电子位于原子核附近。因此,它可以很容易地从外部吸引电子。另外,氟的原子序数为9;它有一个空位轨道来容...
- 发布于 2021-06-28 19:57
- 阅读 ( 1182 )
配价(valency)和共价性(covalency)的区别
...电子数。 Figure 1: The periodic table of elements 除此之外,元素周期表还可以给出元素的价态。第一组元素的价总是1,第二组元素的价是2。 什么是共价性(covalency)? 共价性是原子利用其空轨道可以形成的最大共价键数。共价性取决于...
- 发布于 2021-06-29 08:25
- 阅读 ( 370 )
锕系元素(actinides)和镧系元素(lanthanides)的区别
...tinides) vs. 镧系元素(lanthanides) 锕系元素和镧系元素是元素周期表f区的化学元素。这意味着它们的价电子在原子的f轨道上。这些化学元素以金属形式存在,被称为内过渡金属。f区块仅由镧系和锕系组成。因为锕系元素是从一种叫...
- 发布于 2021-06-29 13:14
- 阅读 ( 535 )
复合(compound)和要素(element)的区别
...、原子序数、熔点、沸点、密度和电离能来区分。在元素周期表中,元素按原子序数排列,按相似的化学性质分组,并用符号表示。 原子序数–原子序数由字母Z表示,是元素原子核中存在的质子数。例如,碳原子核中有6个质子...
- 发布于 2021-07-05 00:20
- 阅读 ( 344 )