分压(partial pressure)和蒸汽压(vapor pressure)的区别
分压和蒸气压是与系统组件施加的压力量有关的常用科学术语,但它们的同一性可能会使其他人混淆。这些术语之间有着明显的区别,包括它们的作用和同一性。本文将详细阐述这些术语之间的区别。它还将包括一些例子来揭开其应用的神秘面纱。
在深入研究蒸汽压和分压之间的区别之前,让我们先强调一下压力的概念。压力在科学上被定义为单位面积施加在物体或物质上的力。它也可以定义为相互碰撞的粒子所施加的力,通常用帕斯卡来测量。在粒子碰撞的情况下,用气体方程和气体动力学理论计算压力。
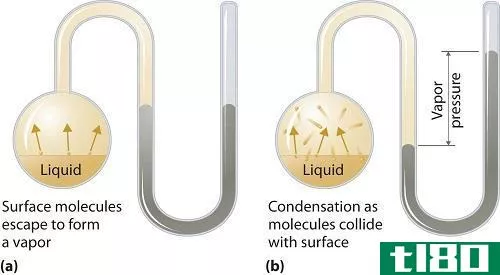
什么是蒸汽压(vapor pressure)?
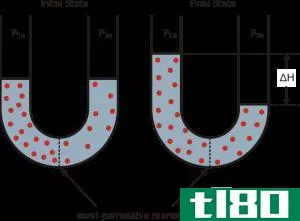
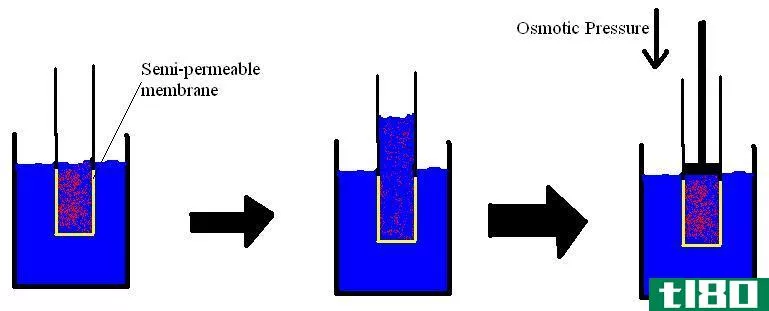
蒸气压可以应用于液相或固相。它是在封闭系统中,当蒸汽和液体(固体)接触时,在给定温度下,蒸汽在其热力学平衡中对其液体或固体施加的压力。这种压力是由于蒸发而产生的,而蒸发是由于固体或液体上的热量增加而产生的。因此,温度被用作汽化的量度,它与蒸汽压成正比。这意味着,温度越高,蒸汽压越高。
在蒸发过程中,空气分子由于较高的动能逸出到封闭系统中的空气中。当处于平衡状态时,蒸汽压力在蒸汽和其冷凝形式的液体(固体)之间产生。在分子间作用力较弱的溶液中,蒸气压往往更大,相反,在分子间作用力较强的溶液中,蒸气压较小。
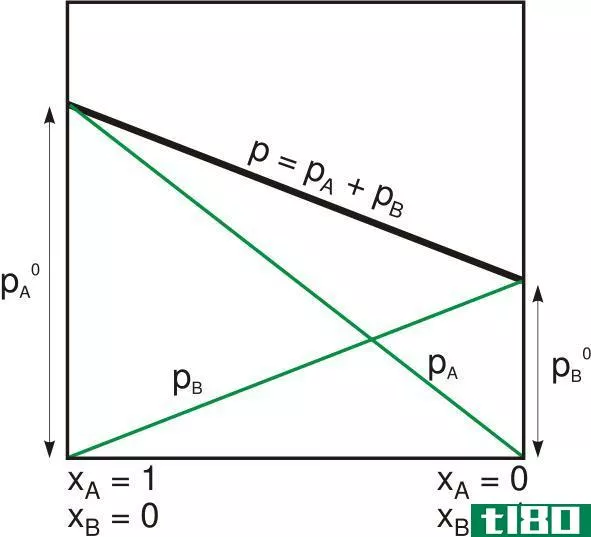
蒸汽压也可以发生在理想的混合物中,这可以用拉乌尔定律来解释。它指出,液体或固体混合物**定组分的部分蒸汽压等于该组分的蒸汽压乘以给定温度下该混合物中该组分的摩尔分数。下面的例子将说明这一点。
Example 1.
Given an ideal mixture of 0.5 mol. ethanol and 1.5 mol. methanol with the vapor pressure of 30KPa and 52KPa, respectively, determine the partial vapor pressure of each component.
Solution:
The total number of moles is 1.5mol + 0.5mol = 2.0mol. According to Raoult’s Law, the partial vapor pressure is equal to the vapor pressure multiplied by the molar fraction of that particular component. In this case, the Pmethanol = 1.5/2 * 52 = 39KPa and Pethanol = 0.5/2 * 30 = 7.5KPa.
当你得到混合物中各组分的分蒸气压时,你可以把它们加在一起得到总蒸气压。在这方面,7.5+39给出了46.5KPa的乙醇和甲醇溶液混合物的总蒸汽压。
影响蒸气压的因素
分子同一性
如上所述,分子力的类型决定了要施加的蒸汽压的大小。如果力越强,则产生的蒸汽压越小,如果力越弱,则产生的蒸汽压越大。因此,液体或固体的成分会影响蒸汽压。
温度
温度越高,蒸汽压越高,因为它会激活更多的动能来破坏分子力,从而使分子迅速逃离液体表面。当蒸汽压(饱和蒸汽压)等于外部压力(大气压)时,液体将开始沸腾。温度越低,蒸汽压越低,液体沸腾需要时间。
Dalton’s Law of Partial Pressures
什么是分压(partial pressure)?
分压的概念最早是由著名科学家约翰道尔顿提出的。它产生了他的分压定律,指出理想气体混合物施加的总压等于单个气体分压之和。假设一个特定的容器充满了氢气、氮气和氧气,总压力PTOTAL等于氧气、氮气和氢气的总和。混合物中任何气体的分压都是用总压乘以单个气体的摩尔分数来计算的。
简而言之,分压是混合物**定气体施加的压力,就好像它在系统中单独起作用一样。因此,在确定单个气体的分压时,可以忽略其他气体。这一理论可以通过在230K的温度下,将0.6atm的氧气注入10.0L的容器中,然后在相同的温度下,将0.4atm的氮气注入相同尺寸的容器中,最后合并气体来测量总压力来验证;它将是两种气体的总和。这清楚地解释了非反应性气体混合物中单个气体的分压。
计算分压
由于道尔顿定律[1]对此作了规定,所以计算分压是一件轻而易举的事。这将取决于提供的典型信息。例如,如果给出了气体a和B的混合物的总压力以及气体a的压力,则可以使用PTOTAL=PA+PB来计算B的分压。剩下的是代数运算。但在只给出混合物总压的情况下,可以用气体B的摩尔分数来确定分压。用X表示的摩尔分数可以用气体B的摩尔数除以气体混合物的总摩尔数得到。然后为了求分压,你要用摩尔分数X乘以总压。下面的例子详细说明了这一点。
Example 2.
A mixture of Nitrogen and Oxygen, with 2.5 moles and 1.85 moles, respectively, is injected in a 20.0L container with a total pressure of 4atm; calculate the partial pressure exerted by the Oxygen gas.
Solution:
The total number of moles in the mixture is 2.5 + 1.85 = 4.35 moles. So the molar fraction of Oxygen, Xo, will be 1.85 moles/4.35 moles = 0.425 moles. The partial pressure of Oxygen will be 0.425 * 4atm = 1.7atm. The partial pressure of the remaining gas can be calculated following the same approach or can be calculated by using the Oxygen gas and the total pressure as elaborated by Dalton’s law of Partial Pressures that the total pressure of non-reactive gases is equal to the sum of the partial pressures.
蒸汽分压差
从上面的解释,很明显,蒸汽压和分压是两个不同的压力。蒸气压作用于液相和固相,而分压作用于气相。在向溶液中加入足够的热量后,蒸汽压在相变中产生,从而导致其分子在封闭系统中逸出。
分压和蒸气压之间的主要区别在于,分压是混合物中单个气体施加的压力,就好像它在该系统中是单独存在的一样,而蒸气压是指蒸汽在其与液体或固体的冷凝状态的热力学平衡中施加的压力。下表简要比较了这些压力。
| 蒸汽压 | 分压 |
| 它是由液体或固体蒸汽平衡地作用在其凝聚相上 | 它由非反应性气体混合物中的单个气体施加 |
| 拉乌尔定律解释得很好 | 道尔顿定律解释得很好 |
| 适用于固相和液相 | 仅适用于气相 |
| 与系统的表面积或体积无关 | 用相同体积的气体计算 |
| 用溶质的摩尔分数计算 | 用气体的摩尔分数计算 |
收工!
蒸汽压和分压是两个重要的科学术语,分别用于确定特定温度下给定封闭系统中蒸汽和气体作用力的影响。它们的主要区别在于应用范围,蒸汽压作用在液相或固相上,而分压作用在给定体积的理想气体混合物中的单个气体上。
根据道尔顿分压定律可以很容易地计算出分压,而蒸气压则是根据拉乌尔定律来计算的。在任何给定的混合物中,每种气体组分都施加自己的压力,称为独立于其他气体的分压。当你把任何组分的摩尔数增加一倍,温度保持不变,你就会增加它的分压。根据克劳修斯-克拉珀龙关系式[2],蒸汽压随着温度的升高而增加。
利用上述信息,你应该能够区分蒸汽压和分压。你也可以用摩尔分数乘以总压强来计算它们。我们给你们举了一些典型的例子来详细说明这些压力的应用。
- 发表于 2021-06-25 01:21
- 阅读 ( 515 )
- 分类:科学
你可能感兴趣的文章
拉乌尔定律(raoult law)和道尔顿定律(dalton law)的区别
...体或液体的蒸气压,而道尔顿定律处理的是非反应气体的分压。 劳尔定律和道尔顿定律是化学中解释气态分压的重要定律。拉乌尔定律描述了改变溶质浓度时溶液蒸汽分压的行为。相反,道尔顿定律描述的是同一容器中非反应...
- 发布于 2020-10-16 16:00
- 阅读 ( 933 )
膨胀压力(turgor pressure)和壁面压力(wall pressure)的区别
...胀压力与壁压的表格形式 6. 摘要 什么是膨胀压力(turgor pressure)? 膨压是当水分进入细胞时,细胞质向细胞壁施加的力。实际上是静水压力。当细胞质因内渗作用而增大体积时,它就发生了。对于植物来说,膨胀压力是非常重要...
- 发布于 2020-10-17 01:55
- 阅读 ( 636 )
真空压力(vacuum pressure)和蒸汽压(vapour pressure)的区别
...力与蒸汽压力的表格形式 6. 摘要 什么是真空压力(vacuum pressure)? 真空压力是真空中的压力。换句话说,如果我们在一个封闭的容器内产生真空,那么这个容器的真空压力就是容器内外的绝对压力之差,当容器外部的压力大于容...
- 发布于 2020-10-17 12:31
- 阅读 ( 417 )
平均自由程(mean free path)和压力(pressure)的区别
平均自由程(mean free path)和压力(pressure)的区别 平均自由程是一个运动的分子与其他分子碰撞时所经过的平均距离。因此,它是用长度测量单位来测量的。平均自由程是用分子的平均速度来确定的,而碰撞频率是因为用距离来...
- 发布于 2020-10-24 02:14
- 阅读 ( 746 )
脉冲(pulse)和脉冲压力(pulse pressure)的区别
...诊脉搏。然而,脉搏率因人而异。 什么是脉冲压力(pulse pressure)? 脉压是收缩压和舒张压之差。它可以测量为脉压=收缩压-舒张压。收缩压是指心脏跳动时血液对动脉壁的压力,舒张压是指心脏在跳动之间休息时,血液对动脉壁...
- 发布于 2020-10-24 10:27
- 阅读 ( 517 )
渗透压(osmotic pressure)和肿大压(oncotic pressure)的区别
渗透压(o**otic pressure)和肿大压(oncotic pressure)的区别 渗透压和溶胀压是生理学的两个重要方面,有助于解释溶质和溶剂分子进出毛细血管系统的运动,尽管这两个术语之间有明显的区别。它们在血液和身体组织成分之间的营养...
- 发布于 2020-10-28 21:48
- 阅读 ( 637 )
收缩(systolic)和舒张压(diastolic pressure)的区别
...收缩压和舒张压的表格形式 6. 摘要 什么是收缩压(systolic pressure)? 收缩压是血压中描述的两个值之一。它是心脏跳动时血液对动脉壁的压力。心脏肌肉收缩,心脏用力将血液泵入主动脉。然后血液对动脉壁施加压力。 图01:收...
- 发布于 2020-11-06 07:31
- 阅读 ( 253 )
分压(partial pressure)和蒸汽压(vapor pressure)的区别
...ol with the vapor pressure of 30KPa and 52KPa, respectively, determine the partial vapor pressure of each component. Solution: The total number of moles is 1.5mol + 0.5mol = 2.0mol. According to Raoult’s Law, the partial vapor pressure is equal to the vapor pressure multiplied by the molar fractio...
- 发布于 2021-06-25 01:21
- 阅读 ( 515 )
高压灭菌器(autoclave)和高压锅(pressure cooker)的区别
...下高压灭菌器和高压锅的主要区别。 什么是高压锅(a pressure cooker)? 压力锅产生的湿热可用于培养基使用前的消毒,使用后的处理。对于液体材料的灭菌,可使用家用压力锅进行湿式或蒸汽灭菌,以防缓慢排气。当一些介质...
- 发布于 2021-06-26 13:08
- 阅读 ( 484 )
大气压(barometric pressure)和大气压力(atmospheric pressure)的区别
...力是指由气压计测量的压力。 什么是大气压力(atmospheric pressure)? 在我们上方,大气中有大量空气。空气的重量不断地向下压着我们,给我们施加压力。大气施加的压力称为大气压力。测量压力的国际单位制是帕斯卡(Pa)。一...
- 发布于 2021-06-27 04:13
- 阅读 ( 562 )