同位素和元素的关键区别在于,同位素是同一化学元素的不同形式,而元素是原子核中质子数相同的原子种类。
类似类型的原子可能会发生轻微变化,形成不同的同位素。一种元素可能有几种同位素。每种同位素的性质决定了元素的性质。在这里,我们将详细讨论同位素和元素,以阐明同位素和元素之间的区别。
目录
1. 概述和主要区别
2. 什么是同位素
3. 什么是元素
4. 并列比较-同位素与表格形式的元素
5. 摘要
什么是同位素(isotopes)?
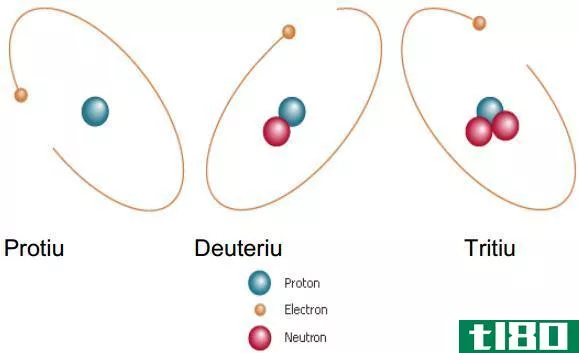
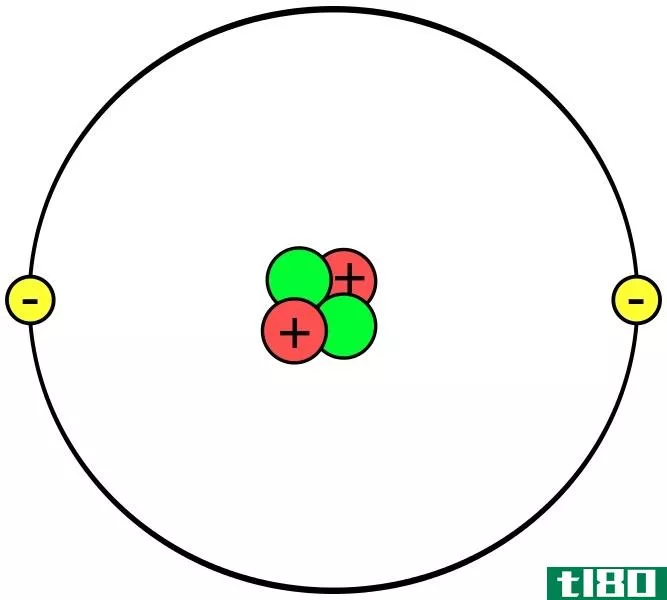
同一元素的原子可以彼此不同。同一元素的这些不同原子是同位素。它们的不同之处在于它们拥有不同数量的中子。由于中子数不同,它们的质量数也不同。然而,质子的同位素数量相同。在自然界中,不同的同位素以不同的数量出现。因此,我们可以给出它们的出现率,称为相对丰度。例如,氢有三种同位素,如钚、氘和氚。它们原子核中的质子数相同,但中子数不同。它们的中子和相对丰度如下。
- 1H–无中子,相对丰度为99.985%
- 2H-一个中子,相对丰度为0.015%
- 3H-两个中子,相对丰度为0%
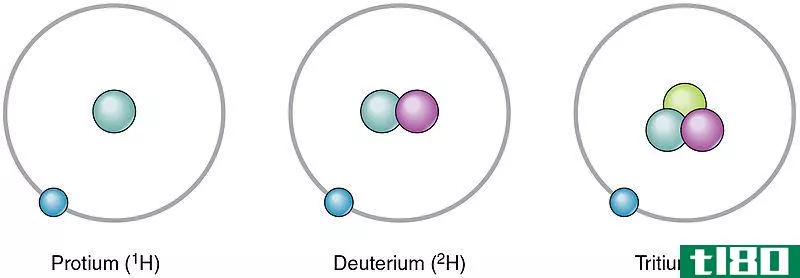
图01:氢同位素
一个原子核所能容纳的中子数因元素而异。在这些同位素中,只有一些是稳定的。例如,氧有三种稳定同位素,锡有十种稳定同位素。大多数情况下,简单元素的中子数和质子数相同。但是在重元素中,中子的数量比质子的数量还要多。
此外,中子数对平衡原子核的稳定性很重要。当原子核太重时,它们就会变得不稳定,因此,这些同位素就会具有放射性。例如,238U发出辐射,衰变成更小的原子核。同位素由于质量不同,可能有不同的性质。例如,它们可以有不同的旋转。因此,它们的核磁共振波谱不同。然而,它们的电子数是相似的,因此产生了相似的化学行为。
什么是元素(elements)?
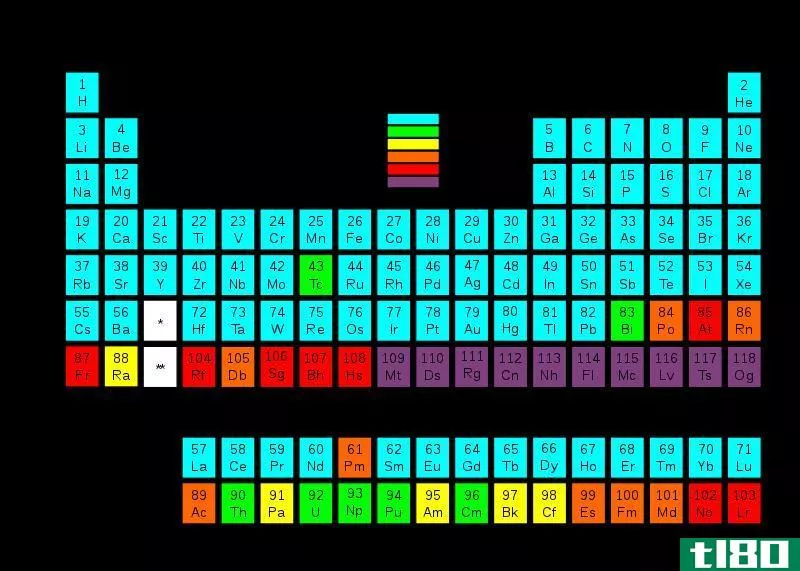
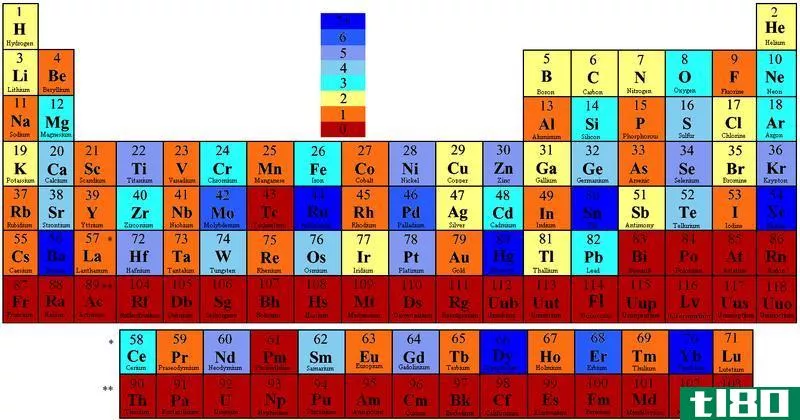
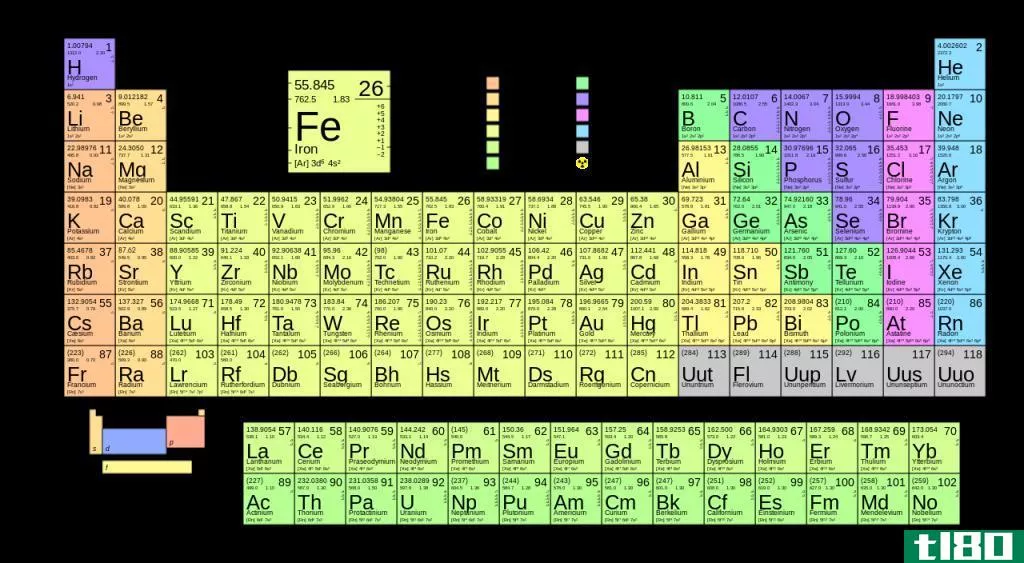
我们对“元素”这个词很熟悉,因为我们在元素周期表中了解了它们。周期表中大约有118种化学元素,它们是按原子序数排列的。元素是一种化学物质,它只代表一种原子类型。因此,它们是纯洁的。此外,同一元素的原子在其原子核中有相同数量的质子。但是,中子的数目可以彼此不同。例如,最小的元素是氢。银、金、铂是一些众所周知的珍贵元素。
每种元素都有一个原子质量、原子序数、符号、电子结构等。尽管大多数元素都是自然存在的,但也有一些合成元素,如加利福尼亚、镅、爱因斯坦和门捷伦。我们可以把所有的元素分为三类:金属、类金属和非金属。
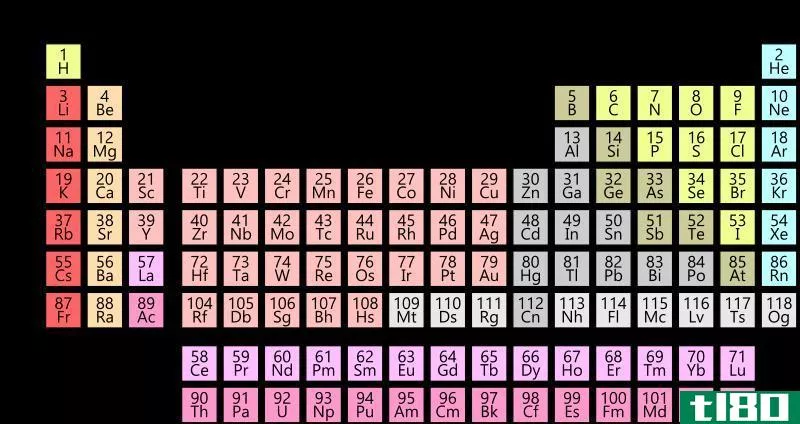
图02:内骨骼
此外,我们可以根据更具体的特征将它们分为组和时期。同样,同一组或同一时间段中的元素具有某些共同的特征,并且在经历组或期间时,某些属性可能会按顺序更改。此外,元素可以发生化学变化,形成各种化合物;然而,我们不能用简单的化学方法进一步分解元素。
同位素(isotopes)和元素(elements)的区别
术语“化学元素”描述一种原子,而术语“同位素”则描述同一化学元素的不同形式。因此,同位素和元素的关键区别在于,同位素是同一化学元素的不同形式,而元素是原子核中质子数相同的原子种类。此外,同位素和元素之间的另一个区别是,同位素有不同数量的中子,但化学元素可以有相同数量的中子,也可以有不同数量的中子;但它们从来没有拥有相同数量的质子。
作为同位素和元素之间的另一个重要区别,我们可以说,一个同位素的原子质量可以通过简单地加上原子核中质子和中子的总质量来计算,而我们可以用同位素的原子质量及其相对丰度来计算化学元素的原子质量。

总结 - 同位素(isotopes) vs. 元素(elements)
同位素是同一化学元素的不同原子形式。同位素和元素的关键区别在于,同位素是同一化学元素的不同形式,而元素是原子核中质子数相同的原子种类。
引用
1“化学元素”,维基百科,维基媒体基金会,2018年11月11日。这里有2个。Helmenstine,Anne Marie博士,“化学中的同位素定义和示例”,ThoughtCo,2018年10月22日。此处提供
2Helmenstine,Anne Marie博士,“化学中的同位素定义和示例”,ThoughtCo,2018年10月22日。