同素异形体(allotropes)和同位素(isotopes)的区别
主要差异同素异形体(main difference allotropes) vs. 同位素(isotopes)
化学元素可以以几种不同的形式自然存在。有时,元素与其他元素结合,有时,元素以其元素形式存在,如金(Au)。然而,有些元素自然以不同的形式出现,但处于相同的物理状态。这种元素称为同素异形体。还有一些元素具有不同形式的原子结构。它们被称为同位素。同素异形体和同位素的主要区别在于同素异形体是在分子水平上定义的,而同位素是在原子水平上定义的。
覆盖的关键领域
1.什么是同素异形体-定义、性质、示例2.什么是同位素-定义、性质、示例3.同素异形体和同位素之间的区别是什么-关键区别的比较
Key Terms: Allotropes, Allotropy, Carbon, Gold, Hydrogen, Isotopes, Sulfur
什么是同素异形体(allotropes)?
同素异形体是同一化学元素在同一物理状态下稳定的不同形式。同素异形体中,同一元素的原子以不同的方式相互结合。换句话说,原子的空间排列是不同的,从一个同素异形体到另一个。同素异形体只由同一元素的原子组成。不同元素的原子不存在组合。
同一化学元素同素异形体的物理状态是相同的。但是同素异形体的分子式可以是相等的,也可以是不同的。因此,同素异形体的化学和物理性质是不同的。
同素异形是用来描述特定化学元素同素异形体的存在或不存在的术语。并非所有的化学元素都有同素异形体。只有一些元素表现出同素异形。下面讨论一些常见的例子。
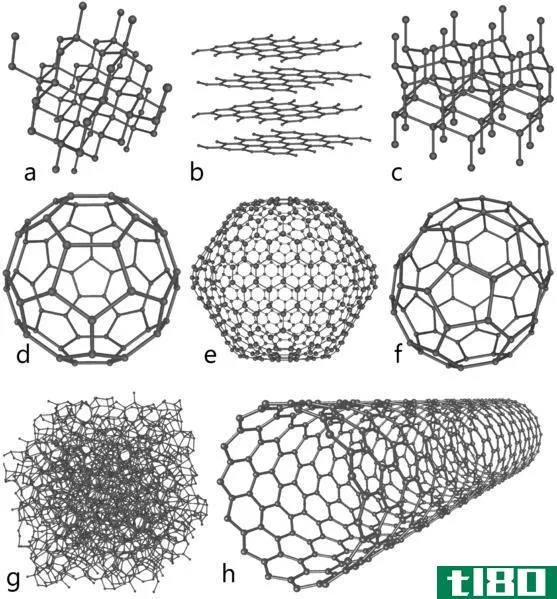
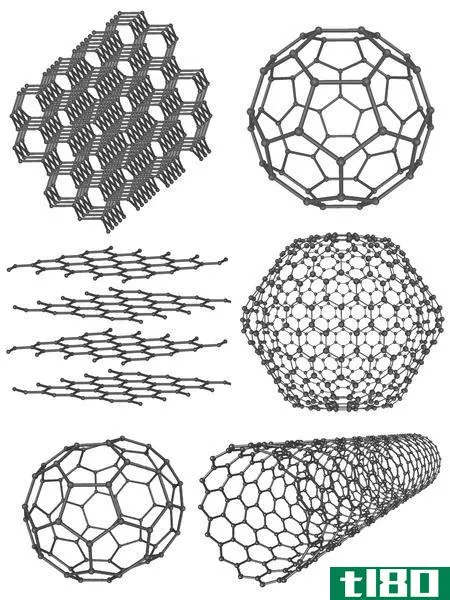
碳(c)
碳是一种显示同素异形的主要化学元素。碳最常见的同素异形体是石墨和金刚石。石墨和金刚石都只由碳原子组成。但它们的分子结构、碳原子杂化等物理性质却各不相同。

Figure 01: Chemical structures and the appearances of Diamond and Graphite
氧气
氧的同素异形体是氧(O2)和臭氧(O3)。它们在自然界中都是气相的,在分子结构、化学和物理性质上都有很大的不同。
硫黄
自然界中的硫以S8单位存在。这些单元由八个硫原子组成。这里,一个硫原子与另外两个硫原子结合形成环状结构。这些环状结构可以是菱形、针状(单斜)或正交形。S8的总体结构是顶部结构。

Figure 02: Crown structure of S8
同素异形是指处于物理状态的分子。因此,液态水和冰不是同素异形体,即使它们都只由水分子(H2O)组成。
什么是同位素(isotopes)?
同位素是同一化学元素的不同形式的原子结构。一般来说,原子是由原子核和围绕原子核的电子云构成的。原子核由质子和中子组成,而电子云只由电子组成。一个元素是由唯一数目的质子组成的。元素的原子序数是质子的数目。因此,每个化学元素都有一个唯一的原子序数。元素周期表是根据元素的原子序数建立的。在这里,化学元素按原子序数的升序排列。然而,存在于原子核中的中子数并不是元素的唯一值。同一元素的原子核中可能有不同数量的中子。这些原子被称为同位素。
特定元素的同位素可以是稳定的,也可以是不稳定的。不稳定的同位素可能经历放射性衰变以获得稳定的形式。下面给出了一些最常见的同位素。
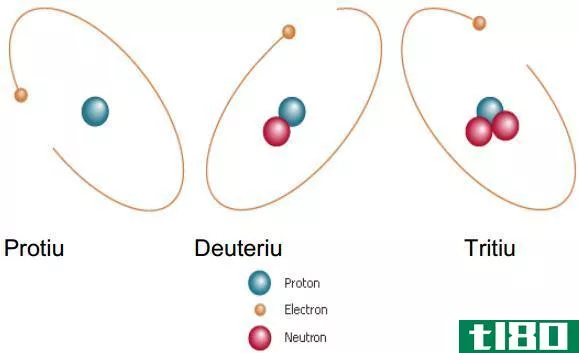
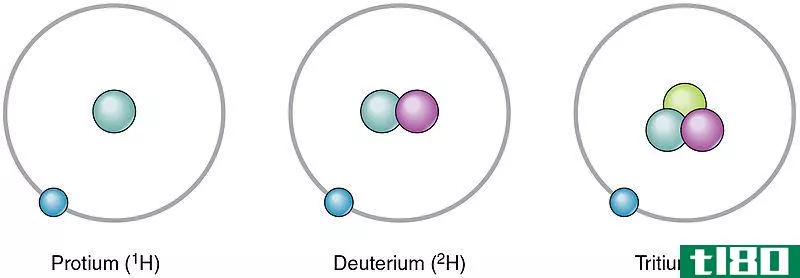
氢(h)
氢的原子序数是1,因此它由1个质子组成。氢有三种常见的同位素。它们是钚、氘和氚。质子没有中子;氘有一个中子,氚有两个中子。

Figure 03: Isotopes of Hydrogen
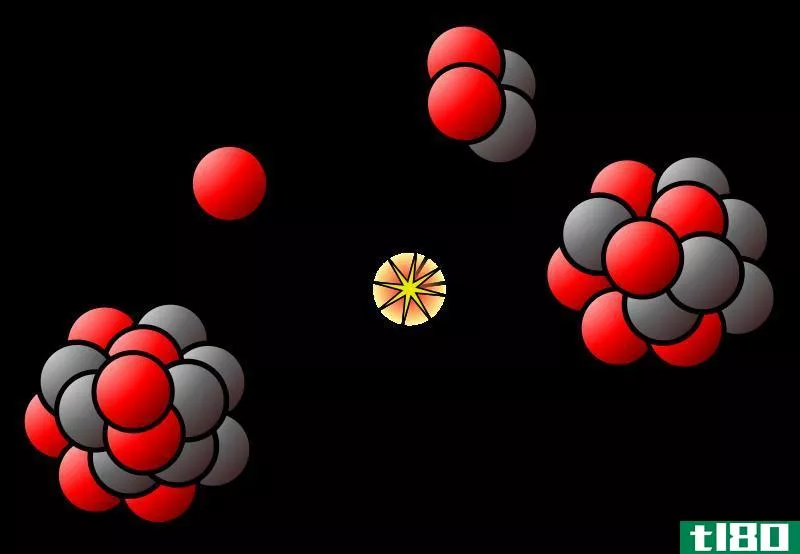
氦
氦由两个质子组成。氦的天然同位素有1个中子或2个中子。

Figure 04: Isotopes of Helium
碳
碳原子也以同位素的形式出现。最常见的碳同位素是由6个中子组成的。有些碳同位素有7或8个中子。
同素异形体(allotropes)和同位素(isotopes)的区别
定义
同素异形体:同素异形体是同一化学元素的不同形式,在相同的物理状态下是稳定的。
同位素:同位素是同一化学元素的不同形式的原子结构。
自然
同素异形体:同素异形体描述分子结构。
同位素:同位素描述原子结构。
群众
同素异形体:同素异形体的摩尔质量可以相等,也可以是不同的。
同位素:同位素的原子序数相同,但原子质量不同。
丰度
同素异形体:并非所有的化学元素都有同素异形体。
同位素:同位素几乎存在于所有元素中。
化学性质
同素异形体:同素异形体的化学性质各不相同。
同位素:由于存在等量的电子,同位素的化学性质相似。
稳定性
同素异形体:同素异形体是天然存在的稳定分子。
同位素:有些同位素是稳定的,而有些则是不稳定的。
结论
同素异形体和同位素都指特定化学元素的不同形式。同素异形体解释了分子结构的差异。同位素解释了原子结构的差异。这是同素异形体和同位素的主要区别。同素异形体在性质上既可以有很小的差异,也可以有很大的差异。但是大多数同位素是根据它们的稳定性而不是其他性质而不同的。同位素的化学性质是相同的,因为它们有相同的电子数。几乎所有的化学性质都取决于电子的数目和排列。
引用
1.赫尔曼斯汀,安妮·玛丽。”什么是同位素?定义和例子。N.p.,N.d.网站。这里有。2017年7月20日。 2.“同位素和同素异形体”今天。N.p.,N.d.网站。这里有。2017年7月20日。 2.“同位素和同素异形体”今天。N.p.,N.d.网站。
- 发表于 2021-06-29 08:37
- 阅读 ( 551 )
- 分类:科学
你可能感兴趣的文章
易裂变的(fissile)和可育同位素(fertile isotopes)的区别
裂变同位素和可育同位素的关键区别在于,可裂变同位素是可以发生裂变反应的物质,而可裂变同位素是可以转化为裂变同位素的材料。 裂变同位素和可育同位素属于核化学范畴。它们定义了两种不同类型的原子,它们的中...
- 发布于 2020-09-16 14:07
- 阅读 ( 265 )
砷(arsenic)和磷(phosphorus)的区别
...合。然而,我们也可以发现它是纯元素晶体。另外,砷的同素异形体有多种,但金属形态的同位素在工业应用中应用较多。砷是自然界中一种单同位素类金属。这意味着它有一个稳定的同位素。 图01:砷 除此之外,砷是一种p-blo...
- 发布于 2020-09-26 23:05
- 阅读 ( 290 )
起源(parent)和子同位素(daughter isotopes)的区别
母同位素和子同位素之间的关键区别在于母同位素经过放射性衰变形成子同位素。 母同位素和子同位素属于化学元素同位素的范畴。同位素是单一化学元素的不同形式。因此,同位素具有相同的原子序数,但质量数不同,因...
- 发布于 2020-10-04 11:13
- 阅读 ( 207 )
硒(selenium)和碲(tellurium)的区别
...它是一种非金属元素,位于周期表的p块中。硒有不同的同素异形体,如黑色、红色和灰色硒。我们可以在地壳上找到这种物质,要么作为纯元素,要么作为矿石的一种成分。E、 g.金属硫化矿。 此外,硒有几种同素异形体,它们...
- 发布于 2020-10-06 03:54
- 阅读 ( 370 )
初级的(primary)和次级动力学同位素效应(secondary kinetic isotope effect)的区别
一级动力学同位素效应与二级动力学同位素效应的关键区别在于,一级同位素效应描述了断裂键处的同位素替代,而次级同位素效应则描述了断裂键附近的同位素替代。 动力学同位素效应(KIE)是指同位素取代后化学反应速...
- 发布于 2020-10-15 04:52
- 阅读 ( 721 )
碳(carbon)和钻石(diamond)的区别
...元素,它以不同的结构存在于自然界中,我们称之为碳的同素异形体。这些结构只含有碳作为化学元素,但碳原子的空间排列是不同的。钻石也是同素异形体的一种。同素异形体的物理性质也不同。 目录 1. 概述和主要区别 2. 什...
- 发布于 2020-10-17 11:02
- 阅读 ( 793 )
同位素(isotopes)和等压线(isobars)的区别
关键区别-同位素与等压线与等温线 同位素是具有不同中子数的同一化学元素的原子。因此,同一化学元素的同位素具有相同的原子序数,但原子质量不同。等压线是不同化学元素的原子。因此,原子序数之间本质上是不同的...
- 发布于 2020-10-19 08:15
- 阅读 ( 440 )
同位素(isotopes)和异构体(isomers)的区别
同位素与异构体 不同的原子之间有变化。同样,在相同的元素中也有变化。同位素是单个元素内部差异的例子。 具有相同分子式的分子或离子可以以不同的方式存在,这取决于键的顺序、电荷分布的差异、它们在空间中的排...
- 发布于 2020-10-20 01:17
- 阅读 ( 229 )
同位素(isotopes)和元素(elements)的区别
同位素和元素的关键区别在于,同位素是同一化学元素的不同形式,而元素是原子核中质子数相同的原子种类。 类似类型的原子可能会发生轻微变化,形成不同的同位素。一种元素可能有几种同位素。每种同位素的性质决定...
- 发布于 2020-10-23 07:34
- 阅读 ( 356 )
稳定同位素(stable isotopes)和放射性同位素(radioisotopes)的区别
稳定同位素(stable isotopes)和放射性同位素(radioisotopes)的区别 同位素是同一化学元素的不同形式,具有不同的原子质量。这意味着某种化学元素的同位素具有相同的原子序数,但原子质量不同。这是因为这些同位素的原子核中...
- 发布于 2020-10-24 02:38
- 阅读 ( 264 )