如何计算理论产量(calculate theoretical yield)
第1部分第1部分,共2部分:寻找极限反应物
- 1从平衡的化学方程式开始。化学方程式就像食谱。它显示了反应物(左侧)反应形成产物(右侧)。一个适当平衡的方程式将显示,进入方程式的原子数与反应物的原子数,与以产物形式出来的原子数相同。例如,考虑简单的方程H2+O2{\displaystyle H\u{2}+O\u{2}}→ H2O{\显示样式H\U2}O}。左右两侧都有两个氢原子。但有两个氧原子作为反应物进入,右边的产物中只有一个原子。为了平衡,将乘积加倍,得到H2+O2{\displaystyle H_{2}+O_{2}→ 2H2O{\displaystyle 2H_{2}O}。检查余额。这一变化修正了氧,现在氧的两面都有两个原子。但现在左边有两个氢原子,右边有四个氢原子。将反应物中的氢加倍。这将把方程调整为2H2+O2{\displaystyle 2H\u{2}+O\u{2}}→ 2H2O{\displaystyle 2H_{2}O}。这种变化现在在两侧有4个氢原子,两个氧原子。方程是平衡的。作为一个更复杂的例子,氧和葡萄糖可以反应生成二氧化碳和水:6O2+C6H12O6{\n 6O{2}+C{6}H{12}O{6}→ 6CO2+6H2O{\displaystyle 6CO\u{2}+6H\u{2}O}在这个等式中,每侧正好有6个碳(C)原子、12个氢(H)原子和18个氧(O)原子。方程是平衡的。如果你想更彻底地复习平衡化学方程式,请阅读本指南。
- 2计算每种反应物的摩尔质量。使用周期表或其他参考资料,查找每种化合物中每个原子的摩尔质量。将它们加在一起,得到每种反应物化合物的摩尔质量。对化合物的单个分子进行此操作。再次考虑将氧和葡萄糖转化为二氧化碳和水的方程式:6O2+C6H12O6{\displaystyle 6O\U2}+C\U6}H\U12}O\U6}→ 6CO2+6H2O{\displaystyle 6CO\uu{2}+6H\u{2}O}在本例中,一个氧分子(O2{\displaystyle O\u{2})包含两个氧原子。一个氧原子的摩尔质量约为16 g/mol。如有必要,您可以找到更精确的值。)2个氧原子x 16 g/mol/原子=32 g/mol O2{\O{2}。另一种反应物葡萄糖(C6H12O6{\displaystyle C{6}H{12}O{6}})的摩尔质量为(6个原子C x 12 g C/mol)+(12个原子H x 1 g H/mol)+(6个原子O x 16 g O/mol)=180 g/mol。要更详细地查看此步骤,可以查看计算摩尔质量。
- 3将每种反应物的量从克换算为摩尔。在实验中,你会知道每一个反应物的质量是多少。将该值除以该化合物的摩尔质量,将量转换为摩尔。例如,假设你从40克氧气和25克葡萄糖开始。40克氧气{\O{2}/(32克/摩尔)=1.25摩尔氧气。25g C6H12O6{\显示型C{6}H{12}O{6}}/(180 g/mol)=约0.139摩尔葡萄糖。
- 4测定反应物的摩尔比。摩尔是化学中用来根据分子质量计算分子数的工具。通过测定氧和葡萄糖的摩尔数,你就知道你从每个分子开始有多少个分子。用一种反应物的摩尔数除以另一种反应物的摩尔数,得出两者之间的比率。在这个例子中,你从1.25摩尔的氧气和0.139摩尔的葡萄糖开始。因此,氧与葡萄糖分子的比率为1.25/0.139=9.0。这个比例意味着你的氧气分子是葡萄糖分子的9倍。
- 5找到反应的理想比例。看看反应的平衡方程式。每个分子前面的系数告诉你发生反应所需的分子比率。如果你精确地使用公式给出的比率,那么两种反应物的使用应该相等。对于该反应,反应物为6O2+C6H12O6{\6O_{2}+C_{6}H_{12}O_{6}。这些系数表明每1个葡萄糖分子需要6个氧分子。该反应的理想比例为6氧/1葡萄糖=6.0。
- 6比较比率,找出限制反应物。在大多数化学反应中,一种反应物会在其他反应物之前用完。首先被耗尽的那一种叫做限制反应物。这个限制性反应物决定了化学反应可以发生多长时间,以及你可以预期的理论产率。比较你计算出的两个比率,以确定限制性反应物:在这个例子中,当以摩尔数测量时,你的氧气是葡萄糖的9倍。这个公式告诉你,你的理想比例是葡萄糖的6倍。因此,你的氧气比需要的多。因此,另一种反应物,葡萄糖,在这种情况下,是限制性反应物。
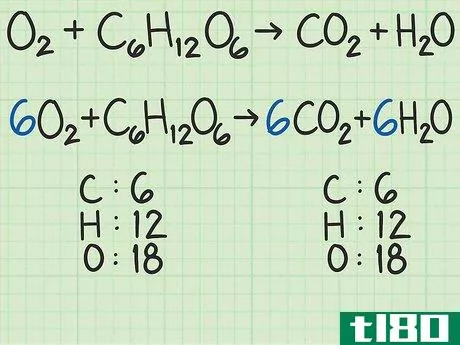
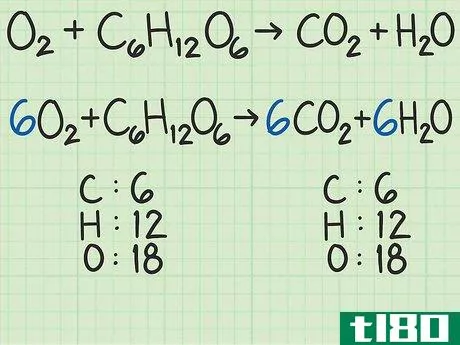
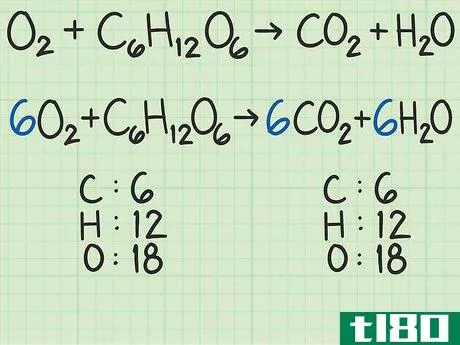
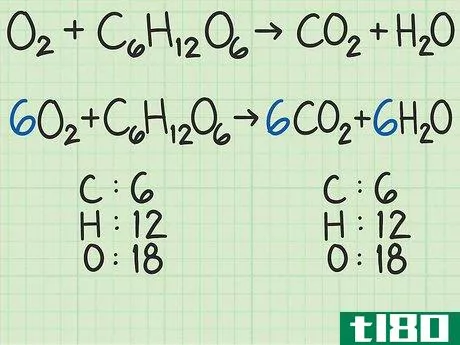
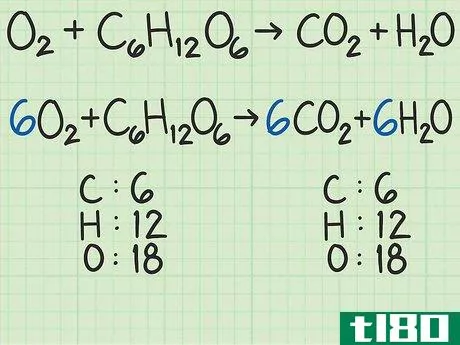
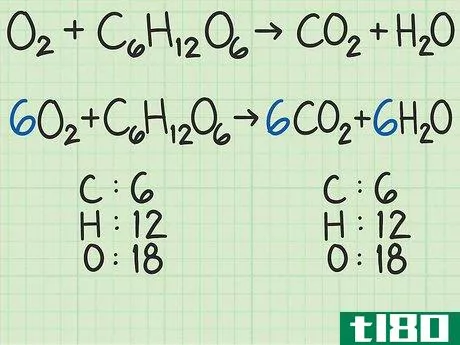
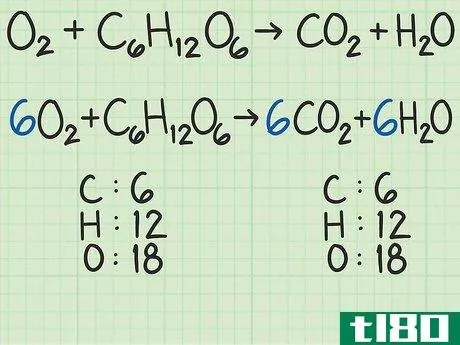
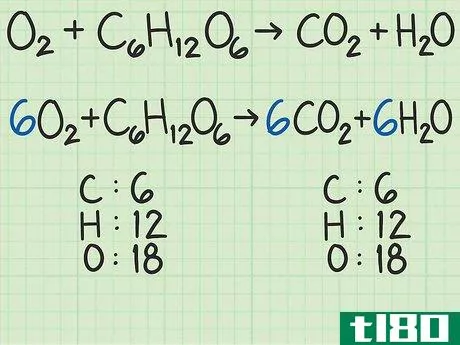
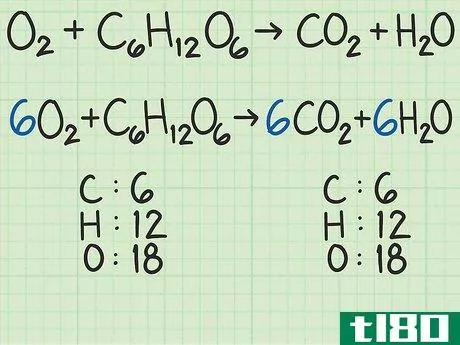









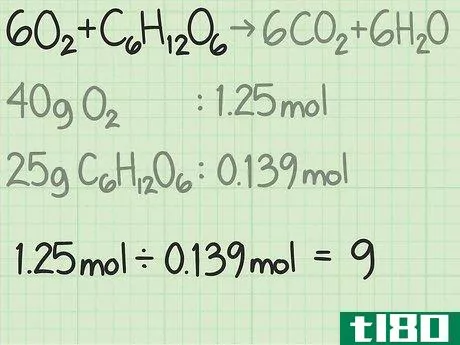
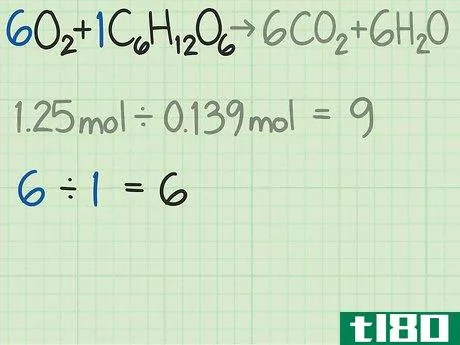
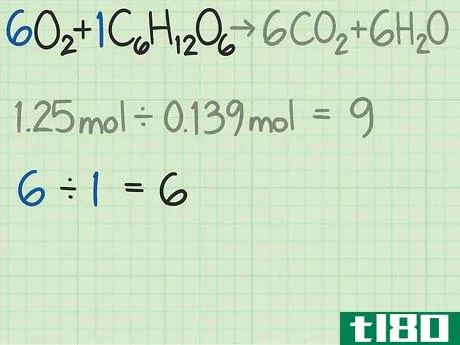
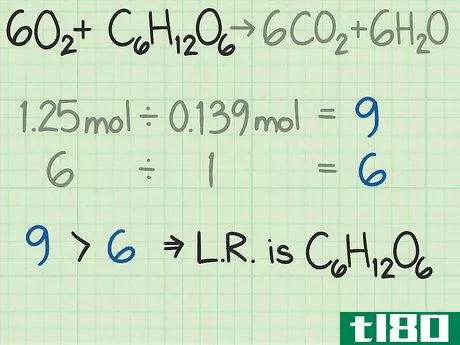
第2部分第2部分,共2部分:确定理论产量
- 1查看反应以找到所需产品。化学方程式的右侧显示了反应生成的产物。如果反应是平衡的,每个产物的系数告诉你以分子比计算的预期量。每种产物都有一个理论产率,也就是说,如果反应完全有效,你期望得到的产物量。继续上面的例子,您正在分析反应6O2+C6H12O6{\displaystyle 6O{2}+C{6}H{12}O{6}→ 6CO2+6H2O{\6CO{2}+6H{2}O}。右边显示的两种产品是二氧化碳和水。你可以从任何一种产品开始计算理论产量。在某些情况下,您可能只关心一种或另一种产品。如果是这样的话,那就是你首先要做的。
- 2写下限制反应物的摩尔数。你必须经常比较反应物的摩尔数和产物的摩尔数。如果你试图比较每一个物体的质量,你将无法得到正确的结果。在上面的例子中,葡萄糖是限制性反应物。摩尔质量计算发现,初始25g葡萄糖等于0.139摩尔葡萄糖。
- 3比较产物和反应物中分子的比例。回到平衡方程式。将所需产物的分子数除以限制反应物的分子数。这个例子的平衡方程是6O2+C6H12O6{\displaystyle 6O{2}+C{6}H{12}O{6}→ 6CO2+6H2O{\6CO{2}+6H{2}O}。这个等式告诉你,你期望得到6个分子的所需产物二氧化碳(CO2{\displaystyle CO{2}),而不是1个分子的葡萄糖(C6H12O6{\displaystyle C{6}H{12}O{6})。二氧化碳与葡萄糖的比率为6/1=6。换句话说,这个反应可以从一个葡萄糖分子中产生6个二氧化碳分子。
- 4乘以极限反应物的摩尔数。答案是理想产物的理论产率,单位为摩尔。在本例中,25克葡萄糖相当于0.139摩尔葡萄糖。二氧化碳与葡萄糖的比例是6:1。你期望产生的二氧化碳摩尔数是葡萄糖摩尔数的六倍。二氧化碳的理论产率为(0.139摩尔葡萄糖)x(6摩尔二氧化碳/摩尔葡萄糖)=0.834摩尔二氧化碳。
- 5将结果转换为克。这与前面计算摩尔数或反应物数的步骤相反。当你知道你期望的摩尔数时,你将乘以产品的摩尔质量,得到理论产率,单位为克。在本例中,CO2的摩尔质量约为44 g/mol(碳的摩尔质量约为12 g/mol,氧的摩尔质量约为16 g/mol,因此总质量为12+16+16=44)乘以0.834摩尔二氧化碳x 44克/摩尔二氧化碳=~36.7克。实验的理论产率为36.7克二氧化碳。
- 6如果需要,对其他产品重复计算。在许多实验中,你可能只关心一种产品的产量。如果你想找到这两种产品的理论产量,只需重复这个过程。在这个例子中,第二种产物是水,H2O{\H_{2}O}。根据平衡方程,你预计6个水分子来自1个葡萄糖分子。这是6:1的比例。因此,从0.139摩尔葡萄糖开始,应产生0.834摩尔水。将水的摩尔数乘以水的摩尔质量。摩尔质量为2+16=18 g/mol。乘以产物,结果为0.834摩尔H2O x 18 g/mol H2O=~15克。本实验的理论产水量为15克。
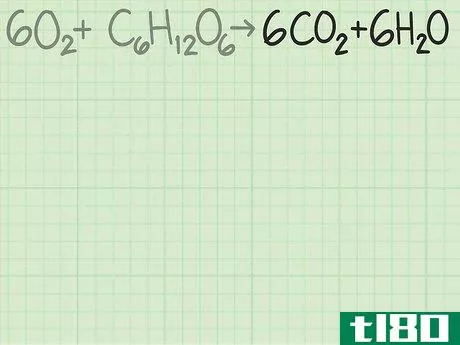
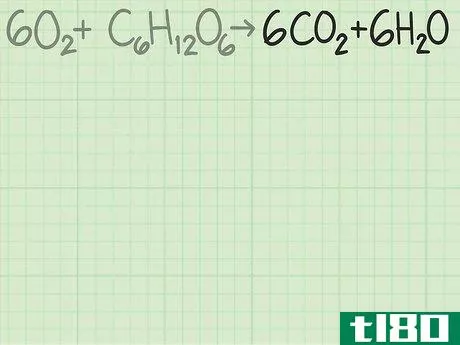
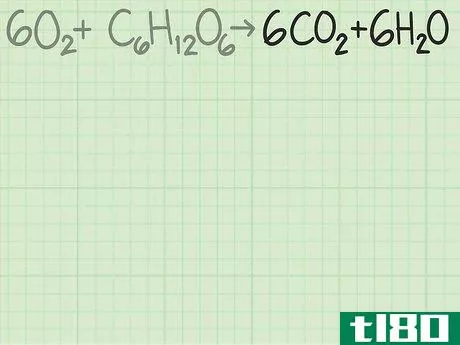
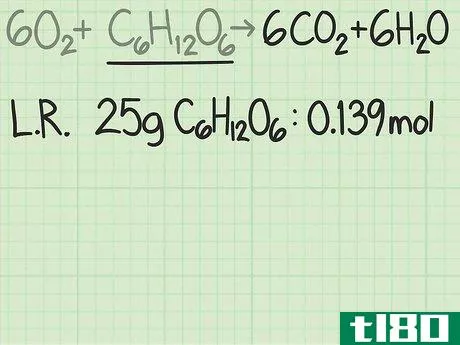
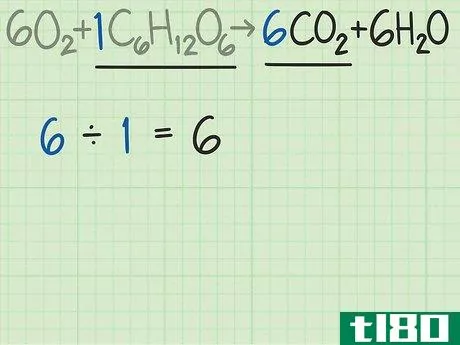
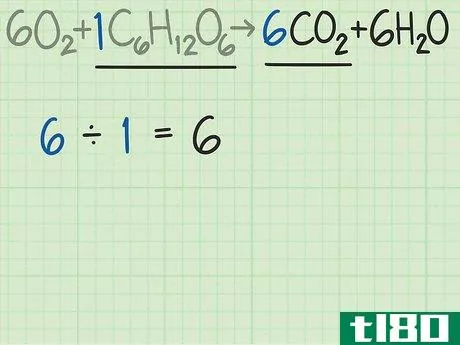
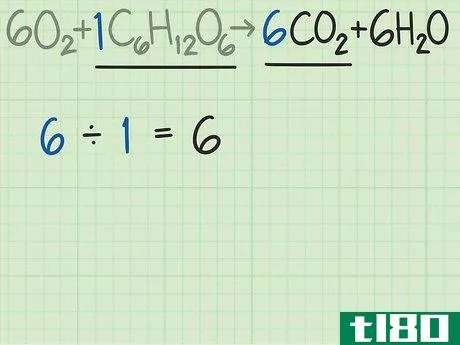
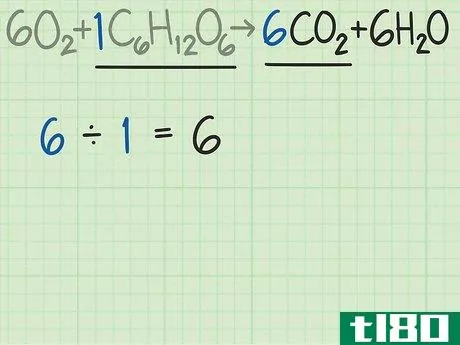
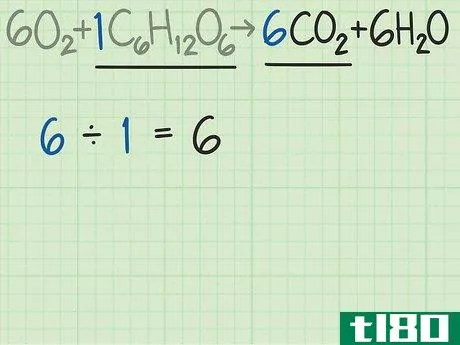


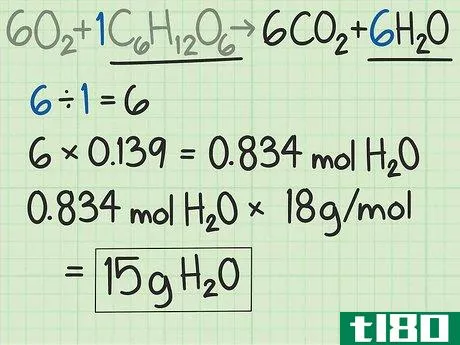
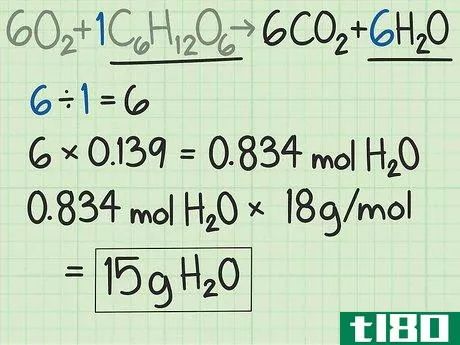
- 发表于 2022-05-18 10:19
- 阅读 ( 84 )
- 分类:教育
你可能感兴趣的文章
百分比收益率(percent yield)和回收率(percent recovery)的区别
...而回收率按纯化合物与初始化合物之比计算。 引用 1.“如何计算回收率。”科学研究。2.Helmenstine,AnneMarie,D.“百分比收益率定义和公式”,《ThoughtCo,2018年1月21日》 img.centered,.aligncenter{display:block;margin:0 auto 24px}.gallery-cap...
- 发布于 2020-09-23 07:20
- 阅读 ( 1133 )
原子经济(atom economy)和百分比收益率(percentage yield)的区别
...物即使在反应完成后仍保留,因为它们是多余的试剂。 如何找到限制试剂? 例:让我们考虑一下Al(14g)和Cl2(4.25g)气体之间的反应。最终产品是三氯化铝。 2Al+3Cl2→2AlCl3 铝的摩尔数=14/26.98=0.52摩尔 Cl2的摩尔数=4.25/70.90=0.06摩...
- 发布于 2020-10-19 08:47
- 阅读 ( 867 )
你的台式打印机比打印服务贵吗?
...但与廉价的打印服务相比,它们可能更贵。在这个简单的如何,学习如何比较成本每打印商业选项。 读者可能不会认为台式打印机“方便”,但**商们主要是销售方便,能够打印在家里。许多商业印刷厂可能提供更便宜的服务,...
- 发布于 2021-04-13 03:34
- 阅读 ( 153 )
实验的(experimental)和理论概率(theoretical probability)的区别
实验概率与理论概率 我们承认不是所有人都喜欢数学。我们总是认为极客只喜欢数学和科学。计算和公式总是会把我们的考试搞砸,因此不及格是不可避免的。 在统计学中,计算不仅是必需的,而且还必须解释计算出的数据。...
- 发布于 2021-06-23 16:30
- 阅读 ( 477 )
年初至今回报(ytd return)和产量(yield)的区别
...同的。它并不表示同样的事情。然而,这两个术语都用于计算股票增长和价值。为了清楚地理解两者之间的区别,让我们看看年初至今回报率和收益率的定义。 年初至今回报(本年迄今回报) 本年迄今回报或本年迄今回报是一...
- 发布于 2021-06-24 18:58
- 阅读 ( 314 )
蟒蛇产量(python yield)和python返回(python return)的区别
...return,以便更好地理解两者之间的区别。 什么是蟒蛇产量(python yield)? yield语句在Python生成器中用于替换函数的返回,以便在不破坏局部变量的情况下将值发送回调用方。为了更好地理解yield语句在Python编程中扮演的角色,...
- 发布于 2021-06-26 01:00
- 阅读 ( 155 )
到期收益(yield to maturity)和当前收益率(current yield)的区别
...l_Yang2/publication/263257602_Yield_to_maturity_and_total_rate_of_return_A_theoretical_note/links/56fc083d08aef6d10d91b910.pdf
- 发布于 2021-07-11 02:33
- 阅读 ( 328 )
产量(yield)和利率(interest rate)的区别
...因是,收益率还考虑了税收优惠等因素。要理解收益率是如何工作的,首先必须深入研究利率的概念。 利率只不过是在本金的基础上获得或支付的金额的百分比。对于定期存款、经常性存款等收益性投资,利率表示收到的金额...
- 发布于 2021-07-13 22:19
- 阅读 ( 373 )
如何计算极限反应物和理论产率(calculate limiting reactant and theoretical yield)
一个反应的限制反应物是当所有反应物一起反应时首先流出的反应物。一旦极限反应物被完全消耗,反应将停止进行。反应的理论产率是限制反应物耗尽时产生的产物量。这个化学问题的实例展示了如何确定极限反应物和计算...
- 发布于 2021-09-06 21:37
- 阅读 ( 523 )
化学中的理论产率定义
...百分比产量表示: Percent yield = Mass of actual yield / Mass of theoretical yield x 100 percent 如何计算理论产量 通过确定平衡化学方程式中的极限反应物,发现了理论产率。为了找到它,第一步是平衡方程,如果它是不平衡的。 下一...
- 发布于 2021-09-07 01:19
- 阅读 ( 505 )