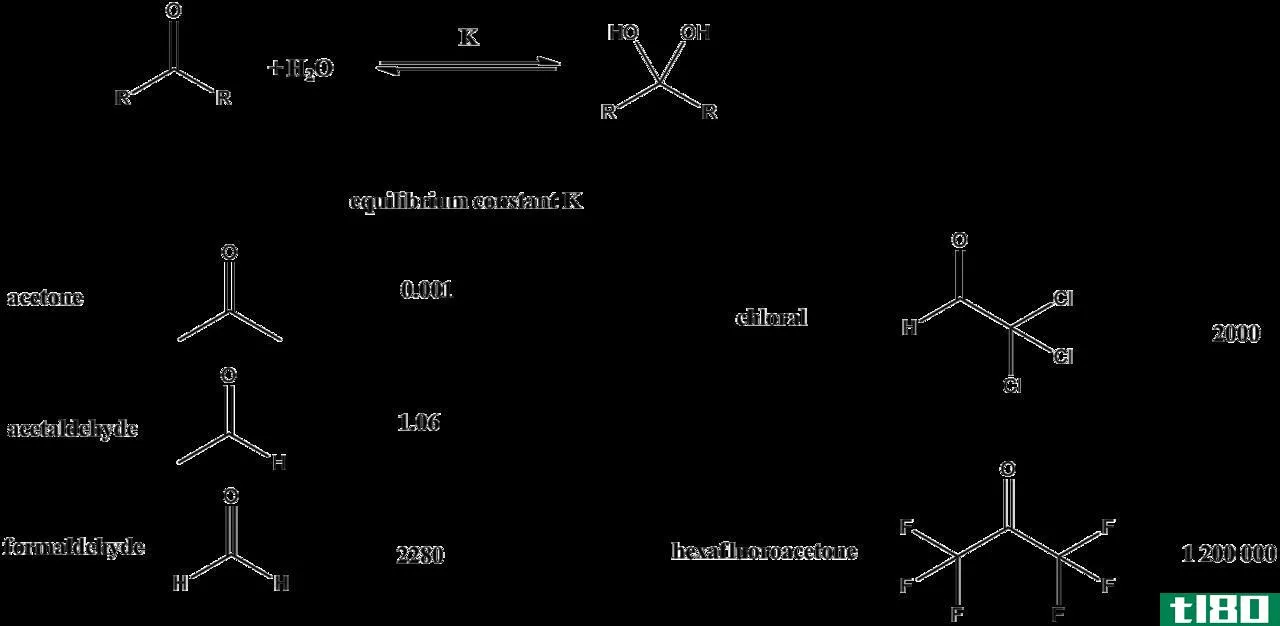
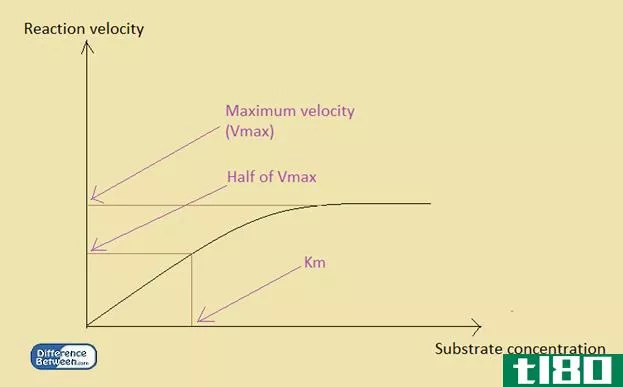
电化学电池的平衡常数
电化学电池氧化还原反应的平衡常数可以用能斯特方程和标准电池电势与自由能之间的关系来计算。这个示例问题展示了如何找到细胞氧化还原反应的平衡常数。

关键收获:找到平衡常数的能斯特方程
- 能斯特方程根据标准电池电势、气体常数、绝对温度、电子摩尔数、法拉第常数和反应商计算电化学电池电势。在平衡时,反应商是平衡常数。
- 所以,如果你知道电池的半反应和温度,你可以解出电池电势,从而解出平衡常数。
问题
以下两个半反应用于形成电化学电池:氧化:SO2(g)+2 H20(ℓ) → SO4-(aq)+4H+(aq)+2E-e°ox=-0.20V析出物:Cr2O72-(aq)+14H+(aq)+6E-→ 2 Cr3+(aq)+7 H2O(ℓ) E°红色=+1.33 V在25℃时,组合电池反应的平衡常数是多少?
解决方案
步骤1:合并并平衡两个半反应。
氧化半反应产生2个电子,还原半反应需要6个电子。为了平衡电荷,氧化反应必须乘以3.3 SO2(g)+6 H20的系数(ℓ) → 3SO4-(aq)+12H+(aq)+6E-+Cr2O72-(aq)+14H+(aq)+6E-→ 2 Cr3+(aq)+7 H2O(ℓ)3 SO2(g)+Cr2O72-(aq)+2 H+(aq)→ 3SO4-(aq)+2Cr3+(aq)+H2O(ℓ)通过平衡方程式,我们现在知道了反应中交换的电子总数。这个反应交换了六个电子。
第2步:计算电池电势。此电化学电池EMF示例问题显示了如何从标准还原电势计算电池电势。**E°电池=E°ox+E°redE°电池=-0.20 V+1.33 V°电池=+1.13 V
步骤3:求平衡常数K。当反应处于平衡状态时,自由能的变化等于零。
电化学电池的自由能变化与方程中的电池电位有关:ΔG=-Nfecell,其中ΔG是反应的自由能n是反应中交换的电子摩尔数f是法拉第常数(96484.56 C/mol),E是电池电位。
电池电势和自由能示例显示了如何计算氧化还原反应的自由能。如果ΔG=0:,则求解Ecell0=-nFEcellEcell=0 V这意味着,在平衡状态下,电池电势为零。反应以相同的速率向前和向后进行,这意味着没有净电子流。在没有电子流的情况下,没有电流,电势等于零。现在有足够的信息可以利用能斯特方程来求平衡常数。
能斯特方程为:Ecell=E°电池-(RT/nF)x log10Q其中Ecell为电池电位E°电池为标准电池电位R为气体常数(8.3145 J/mol·K)T为绝对温度F为电池反应转移的电子摩尔数F为法拉第常数(96484.56 C/mol)Q为反应商
**Nernst方程示例问题演示了如何使用Nernst方程计算非标准电池的电池电势**
在平衡状态下,反应商Q是平衡常数K。这使得方程为:Ecell=E°cell-(RT/nF)x log10k。从上面我们知道:Ecell=0 VE°cell=+1.13 VR=8.3145 J/mol·KT=25&;degC=298.15 KF=96484.56 C/moln=6(六个电子在反应中转移)
求解K:0=1.13V-[(8.3145J/mol·kx298.15K)/(6x96484.56C/mol)]log10K-1.13V=-(0.004 V)log10Klog10K=282.5K=10282.5K=10282.5=100.5x10282K=3.16x10282答:电池氧化还原反应的平衡常数为3.16x10282。
- 发表于 2021-09-15 09:52
- 阅读 ( 285 )
- 分类:化学
你可能感兴趣的文章
能斯特方程(nernst equation)和高盛方程(goldman equation)的区别
...程是能斯特方程的导数,描述了细胞膜上的反转电位。 电化学电池是利用化学反应的化学能发电的电气装置。或者,我们可以用这些装置通过提供所需的电能来辅助化学反应。电化学电池的还原电位决定了电池产生电的能力。 ...
- 发布于 2020-10-03 22:50
- 阅读 ( 1886 )
利率法(rate law)和群众行动定律(law of mass action)的区别
...质量作用定律。这一定律有助于获得特定化学反应的精确平衡方程。这个定律也由反应物的活性或浓度给出。根据质量作用定律,反应混合物处于平衡状态时,产物浓度与反应物浓度之比为常数。 质量作用定律是一个普遍的概...
- 发布于 2020-10-05 12:19
- 阅读 ( 570 )
ksp公司(ksp)和凯克(keq)的区别
...Ksp一词描述了物质的溶解度,而Keq一词描述了特定反应的平衡状态。 Ksp代表溶度积常数,Keq代表平衡常数。Ksp也是一种平衡常数,但它只涉及固体物质的溶解度。Keq是一个更一般的术语,我们可以用来确定任何类型的平衡态的...
- 发布于 2020-10-12 08:40
- 阅读 ( 536 )
平衡常数(equilibrium constant)和形成常数(formation constant)的区别
平衡常数与生成常数的关键区别在于,平衡常数是平衡时产物浓度与反应物浓度之比,而生成常数是由其组分形成配位化合物的平衡常数。 平衡常数有助于解释不同平衡态的行为。形成常数是一种平衡常数,对配位化合物的...
- 发布于 2020-10-15 00:59
- 阅读 ( 219 )
平衡常数(equilibrium constant)和速率常数(rate constant)的区别
平衡常数和速率常数的关键区别在于,平衡常数用反应物和产物的浓度来表示,而速率常数用反应物或产物的浓度来表示。 平衡常数和速率常数都是特定反应的常数。这意味着,在一个恒定的反应中,温度、平衡常数的值和...
- 发布于 2020-10-15 10:42
- 阅读 ( 345 )
同种类的(homogeneous)和非均相平衡(heterogeneous equilibrium)的区别
均相平衡与非均相平衡的关键区别在于,在均相平衡中,反应物和产物处于物质的同一相,而在非均相平衡中,反应物和产物处于不同的相。 平衡是反应物和产物的浓度保持恒定的状态。平衡分为均相平衡和非均相平衡两种...
- 发布于 2020-10-15 11:11
- 阅读 ( 622 )
kc公司(kc)和kp公司(kp)的区别
关键区别–kc与kp Kc和Kp是平衡常数。反应混合物的平衡常数是表示反应混合物中产物和反应物的浓度或压力之比的数字。Kc和Kp的关键区别在于Kc是由浓度项给出的平衡常数,而Kp是由压力项给出的平衡常数。 这个平衡常数是...
- 发布于 2020-10-19 00:35
- 阅读 ( 253 )
平衡常数(equilibrium constant)和平衡位置(equilibrium position)的区别
关键区别-平衡常数与平衡位置 平衡常数是表示反应混合物在其平衡状态下的产物和反应物数量之间关系的数字,而平衡位置是平衡的正向反应等于反向反应的时刻。这是平衡常数和平衡位置的关键区别。 平衡是一个系统同...
- 发布于 2020-10-19 02:44
- 阅读 ( 567 )
逐步(stepwise)和总稳定常数(overall stability constants)的区别
...与整体稳定常数 稳定常数是指溶液中形成复杂化合物的平衡常数。这是一种测量这些过渡金属离子配合物稳定性的方法。与其他平衡常数一样,稳定常数也与温度有关。稳定常数的定义为“过渡金属离子与某些过渡金属离子发...
- 发布于 2020-10-19 14:00
- 阅读 ( 498 )
kd公司(kd)和公里(km)的区别
关键区别–kd vs km Kd和Km是平衡常数。Kd和Km的主要区别在于Kd是一个热力学常数,而Km不是热力学常数。 Kd为离解常数,Km为米氏常数。这两个常数在酶反应的定量分析中都非常重要。 目录 1. 概述和主要区别 2. 什么是Kd 3. 什么...
- 发布于 2020-10-22 19:32
- 阅读 ( 326 )