酸离解常数定义:ka
酸离解常数是酸离解反应的平衡常数,用Ka表示。该平衡常数是溶液中酸强度的定量量度。Ka通常以mol/L为单位表示。有酸离解常数表,便于参考。对于水溶液,平衡反应的一般形式为:
 HA + H2O ⇆ A- + H3O+
HA + H2O ⇆ A- + H3O+其中,HA是在酸A-和氢离子的共轭碱中离解的酸,氢离子与水结合形成氢离子H3O+。当HA、A-和H3O+的浓度不再随时间变化时,反应处于平衡状态,可计算解离常数:
Ka = [A-][H3O+] / [HA][H2O]其中方括号表示浓度。除非酸的浓度非常高,否则通过将水的浓度保持为常数来简化方程式:
HA ⇆ A- + H+ Ka = [A-][H+]/[HA]酸离解常数也称为酸度常数或酸离子化常数。
关于ka和pka
相关值为pKa,它是对数酸离解常数:
pKa=-log10Ka
用ka和pka预测酸的平衡和强度
Ka可用于测量平衡位置:
- 如果Ka较大,则有利于离解产物的形成。
- 如果Ka较小,则倾向于未溶解酸。
Ka可用于预测酸的强度:
- 如果Ka大(pKa小),这意味着酸大部分是解离的,因此酸很强。pKa小于-2的酸是强酸。
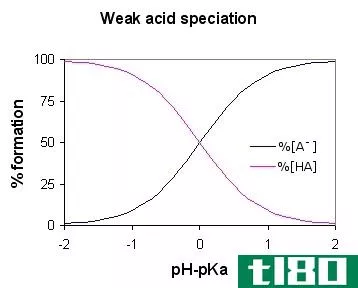
- 如果Ka较小(pKa较大),则很少发生离解,因此酸较弱。水中pKa在-2到12范围内的酸是弱酸。
Ka比pH更能衡量酸的强度,因为向酸溶液中加水不会改变其酸平衡常数,但会改变H+离子浓度和pH值。
ka示例
酸HB的酸离解常数Ka为:
HB(aq) ↔ H+(aq) + B-(aq) Ka = [H+][B-] / [HB]对于乙醇酸的离解:
CH3COOH(aq) + H2O(l) = CH3COO-(aq) + H3O+(aq) Ka = [CH3COO-(aq)][H3O+(aq)] / [CH3COOH(aq)]酸碱离解常数
在已知pH值的情况下,可以找到酸离解常数。例如:
计算发现pH值为4.88的0.2 M丙酸水溶液(CH3CH2CO2H)的酸离解常数Ka。
要解决这个问题,首先,写出反应的化学方程式。你们应该能够识别丙酸是一种弱酸(因为它不是强酸之一,而且它含有氢)。它在水中的离解是:
CH3CH2CO2H + H2 ⇆ H3O+ + CH3CH2CO2-建立一个表格,记录初始条件、条件变化和物种平衡浓度。这有时被称为冰桌:
| CH3CH2CO2H | H3O+ | CH3CH2CO2- | |
| 初始浓度 | 0.2米 | 0米 | 0米 |
| 浓度变化 | -x M | +x M | +x M |
| 平衡浓度 | (0.2-x)米 | x M | x M |
现在使用pH公式:
pH = -log[H3.o+] -ph=对数[h]3.o+] = 4.88 [h]3.o+= 10-4.88=1.32 x 10-5为x插入此值以求解Ka:
KA.=[h3.o+][ch3.中国2.有限公司2.-]/[ch3.中国2.有限公司2.h] KA.=x2./(0.2-x) KA.=(1.32 x 10)-5)2./(0.2-1.32 x 10-5) KA.=8.69 x 10-10- 发表于 2021-10-08 02:17
- 阅读 ( 462 )
- 分类:化学
你可能感兴趣的文章
酸电离常数(acid ionization constant)和碱基电离常数(base ionization constant)的区别
...-酸电离常数与碱电离常数 酸离子化常数(Ka,也称为酸离解常数)定量测量了酸分子与其电离形式之间的平衡。同样,碱离解常数(Kb,或碱离解常数)可定量测量碱分子与其电离形式之间的平衡。酸电离常数和碱电离常数的关...
- 发布于 2020-10-19 03:06
- 阅读 ( 436 )
pka公司(pka)和巴基斯坦卢比(pkb)的区别
关键区别——pka与pkb pKa和pKb是化学中常见的离解常数。pKa为酸离解常数,pKb为碱离解常数。这些术语用于使处理非常大或非常小的值变得容易。这些术语中的“p”代表“负对数”。pKa和pKb的关键区别在于pKa是Ka的负对数,而p...
- 发布于 2020-10-19 14:31
- 阅读 ( 518 )
浓酸(concentrated acid)和强酸(strong acid)的区别
...有两种主要类型,即强酸和弱酸。强酸是在水溶液中完全离解,释放H+离子的酸。强碱是在水溶液中完全离解形成OH-离子的化合物。根据水溶液中酸分子的浓度,这些酸可以有浓酸和稀酸两种形式。浓酸和强酸的关键区别在于,...
- 发布于 2020-10-19 14:49
- 阅读 ( 393 )
虚弱的(weak)和强酸(strong acid)的区别
...释放氢离子(H+)的总量释放到溶液中。对于这些酸,酸离解常数Ka是一个小值。这些溶液的pH值在3到5之间。这主要是因为这些弱酸不能像强酸那样提高溶液中的氢离子含量。 图01:弱酸形态图(弱酸HA) 由于弱酸部分解离,水...
- 发布于 2020-10-23 09:57
- 阅读 ( 357 )
酸的(acid)和酸的(acidic)的区别
...键的化合物。 图01:盐酸与NH4OH碱的反应 我们可以从酸的离解常数或Ka来测量酸的强度。这就是酸分解成离子的量。对于HA酸分解成H+和A-离子,我们可以写出一个确定Ka值的方程式,如下所示: Ka=[H+][A–]/[HA] 碱能中和酸。酸和碱...
- 发布于 2020-11-05 21:23
- 阅读 ( 323 )
弱碱(weak base)和坚实的基础(strong base)的区别
...。 什么是坚实的基础(strong base)? 强碱在溶液中完全离解产生离子。它们的pH值在10到14之间。 强碱对活组织有腐蚀性,会造成严重影响。强碱的常见例子是碱金属和碱土金属的氢氧化物。 即使在无水的情况下,强碱也能使...
- 发布于 2021-06-25 17:49
- 阅读 ( 296 )
坚强的(strong)和弱酸(weak acids)的区别
...和弱酸的区别是什么?主要区别的比较 关键词:酸,酸离解常数,脱质子,pH值,极性,质子,强酸,弱酸 什么是强酸(a strong acid)? 强酸是在水中完全分解成离子的分子。换句话说,酸通过完全电离将H+离子释放到溶液中。酸...
- 发布于 2021-06-28 19:21
- 阅读 ( 1043 )
盐酸(hydrochloric acid)和盐酸(muriatic acid)的区别
...)。因此,盐酸在水中完全分解。因此,它具有较高的酸离解常数(Ka)。 盐酸在实验室和工业上有许多应用。这种工业规模的应用之一是精炼金属。这种酸用于精炼金属,因为大多数金属很容易溶解在其中。 Figure 1: The Lewis Str...
- 发布于 2021-06-28 19:45
- 阅读 ( 452 )
巴基斯坦航空公司(pka)和酸碱度(ph)的区别
...很容易处理的简单值。pKa和pH的主要区别在于pKa表示酸的离解,而pH表示体系的酸碱度。 覆盖的关键领域 1.什么是pKa–定义、价值观、关系2.什么是pH–定义、价值观、关系3.pKa和pH之间的区别是什么–关键区别的比较 关键词:酸...
- 发布于 2021-06-28 20:09
- 阅读 ( 334 )
酸碱度(ph)和酸度(acidity)的区别
...中。弱酸部分电离并释放一些质子,从而达到平衡。 酸离解常数给出了溶液酸度的概念。例如,让我们考虑酸“HA”的离解。 透明质酸+水↔ A–+H3O+ HA的酸离解常数如下所示。 Ka=[A–][H3O+]/[HA] 根据上述方程,离子浓度的变化可...
- 发布于 2021-06-29 08:16
- 阅读 ( 492 )