关键区别-酸电离常数与碱电离常数
酸离子化常数(Ka,也称为酸离解常数)定量测量了酸分子与其电离形式之间的平衡。同样,碱离解常数(Kb,或碱离解常数)可定量测量碱分子与其电离形式之间的平衡。酸电离常数和碱电离常数的关键区别在于,酸电离常数是对酸在溶液中的强度的定量测量,而碱电离常数是对溶液中碱的强度的定量测量。
离子化是将分子分离成离子物种(阳离子和阴离子)。平衡常数是反应物和相互平衡的产物的量之间的关系。
目录
1. 概述和主要区别
2. 什么是酸电离常数
3. 什么是碱基电离常数
4. 并列比较-以表格形式列出酸电离常数与碱电离常数
5. 摘要
什么是酸电离常数(acid ionization c***tant)?
酸电离常数是表示酸分子与存在于同一溶液中的离子种类之间关系的数值。酸离解常数用Ka表示。它是对溶液中酸的强度的定量测量。酸的强度取决于酸在水溶液中的电离(或解离)。

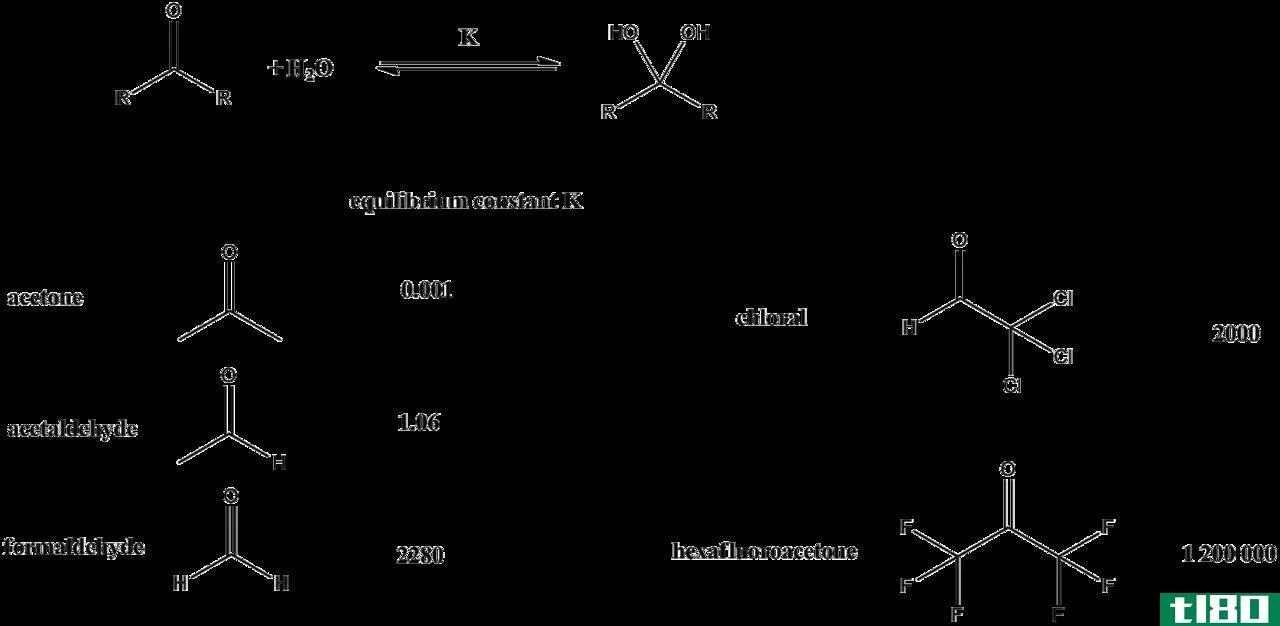
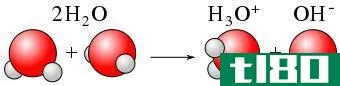
图01:酸电离示例
酸的离子化可以给出如下公式,
透明质酸+水↔ A–+H3O+
在这里,HA是一种弱酸,部分分解成离子;阴离子被称为该特定酸的共轭碱。酸分解释放出一个质子(氢离子;H+)。这个质子与水分子结合形成氢离子(H3O+)。这种HA酸的酸离子化常数如下所示:,
Ka=[A-][H3O+]/[HA][H2O]
Ka的常见形式是pKa,它是Ka的负对数值。这是因为Ka值很小,很难处理。pKa给出了一个简单易处理的数字。可以给出如下:,
pKa=-log(Ka)
Ka或pKa值可以用来表示酸的强度。
- 弱酸的Ka值较低,pKa值较高
- 强酸具有较高的Ka值和较低的pKa值。
什么是碱基电离常数(base ionization c***tant)?
碱基电离常数是表示碱分子与存在于同一溶液中的离子物种之间关系的数值。用Kb表示。它测量溶液中碱基的强度。Kb越高,碱基的电离度越高。对于溶液中的某一碱,碱离解常数可给出如下:,
B+水↔ BH++哦-
Kb=[BH+][OH–]/[B][H2O]
因为基的Kb值非常小,所以使用Kb的负log值代替Kb。Kb的负日志值用pKb表示。pKb给出了一个易于处理的数字。
pKb=-log(Kb)
碱基的强度可以用Kb值或pKb值表示,如下所示。
- 碱基电离常数越大,碱基越强(pKb越低)
- 碱基电离常数越低,碱基越弱(pKb越高)
酸电离常数(acid ionization c***tant)和碱基电离常数(base ionization c***tant)的区别
| 酸电离常数vs碱电离常数 | |
| 酸电离常数是表示酸分子与存在于同一溶液中的离子种类之间关系的数值。 | 碱基电离常数是表示碱分子与存在于同一溶液中的离子物种之间关系的数值。 |
| 概念 | |
| 酸的电离常数表示酸的强度。 | 碱基电离常数给出碱的强度。 |
| 日志值 | |
| Ka的负对数值为pKa。 | Kb的负日志值是pKb。 |
| 常数的值 | |
| 弱酸具有较低的Ka值和较高的pKa值,而强酸具有较高的Ka值和较低的pKa值。 | 弱碱基具有较低的Kb值和较高的pKb值,而强碱基具有较高的Kb值和较低的pKb值。 |
总结 - 酸电离常数(acid ionization c***tant) vs. 碱基电离常数(base ionization c***tant)
酸电离常数和碱电离常数分别是酸碱强度的量度。酸电离常数和碱电离常数的区别在于,酸电离常数是对酸在溶液中的强度的定量测量,而碱电离常数是对溶液中碱的强度的定量测量。
引用
1.“16.4:酸强度和酸离解常数(Ka)。”化学歌词,歌词,2017年2月26日。此处提供2.“强弱碱和碱电离常数(Kb)”,CK-12基金会,CK-12基金会,2016年9月11日。这里有3。“酸和碱:电离常数。”酸和碱的电离。这里有
2.“强弱碱和碱电离常数(Kb)”,CK-12基金会,CK-12基金会,2016年9月11日。
3.“酸和碱:电离常数。”酸和碱的电离