酸的(acid)和基础(base)的区别
根据不同理论对碱和酸的定义
根据酸碱反应的路易斯理论,碱是任何能够提供一部分非键电子以形成新键的物质。Lewis理论还将酸定义为能够接受一对非键电子以形成新键的任何物质。Lewis酸碱反应的一般形式为:
A++Bˉ=>;A-B
其中A+是电子受体或路易斯酸,而Bˉ是电子供体或路易斯碱,A-B是配位共价化合物。根据路易斯理论,反酸也可以称为亲电路易斯酸,而碱也可以称为亲核或路易斯碱。
根据Arrhenius1887理论,酸是一种物质,在水中容易分解成带电原子或分子,称为离子,其中一种是氢离子(H+)。Arrhenius还制定了相应的碱定义,即在水中容易电离成氢氧化物离子(OH-)的物质。
Arrhenius对酸和碱的描述是狭义的,因为它涵盖了许多最常见的酸和碱及其化学反应,但也有其他具有酸特性但不属于此Arrhenius定义的材料。
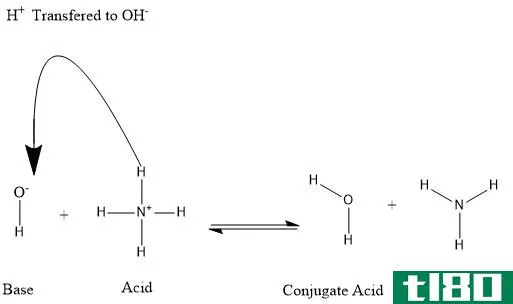
根据托伯斯坦德·劳里的酸碱理论,酸和碱相互作用,使酸形成共轭酸,而碱通过交换质子形成共轭碱。无论溶剂是什么,只要质子从一种反应物转移到另一种反应物,就会发生布朗斯特德-洛瑞酸碱反应。
根据该理论,酸是一种能够提供质子或氢离子的化学物质,而碱是一种能够在水溶液中接受质子或氢离子的物质。Bronstead-Lowry理论是一种更具包容性的定义,能够描述各种条件下的酸碱行为。
关于酸,你需要知道什么
酸的特性

- 酸是任何提供质子的物质。
- 酸导电(即它们是电解质)。
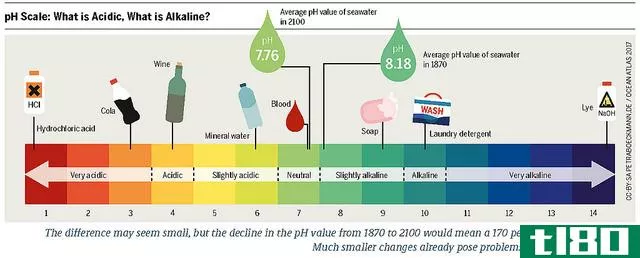
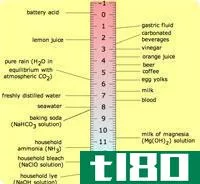
- 酸的PH值小于7.0
- 根据温度的不同,酸可以以固态、气态或液态出现。
- 酸有酸味。
- 酸与金属反应生成氢气。
- 酸的化学式以H开始,例如盐酸(HCL)、硼酸(H3BO3)、硫酸(H2SO4)和碳酸(CH2O3)。
- 酸具有腐蚀性。
- 酸的强度取决于氢离子的浓度。
- 所有的酸都能把蓝色的石蕊纸变成红色。
- 当酸溶解在酚酞中时,溶液的合成颜色为无色。
酸的种类
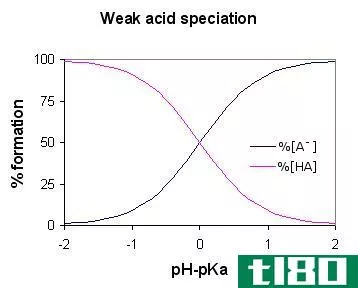
此外,根据溶液中产生的氢离子或氢氧化物离子浓度,酸碱可分为弱酸碱。酸的强度是指酸在水相中失去或提供质子的容易程度。分子的极性和原子中含有氢离子的共价键的强度是影响酸强度的两个重要因素。
强酸
一种强酸,在溶液中更容易电离或解离,产生氢离子。六种常见的强酸是:
- 硝酸(HNO3)
- 高氯酸(HCLO4)
- 硫酸(H2SO4)
- 氢碘酸(HI)
- 氢溴酸(Hbr)
- 盐酸(HCl)。
弱酸
弱酸是指在水溶液或水中不能完全分解成离子的酸。例如,氢氟酸在水中分解成氢离子(H+)和氟离子(F-),但一些氢氟酸仍处于不溶状态,因此,氢氟酸不是强酸。还需要注意的是,大多数有机酸都是弱酸。弱酸的例子包括:
- 草酸(HO2C2O2H)
- 亚硫酸(H2SO3)
- 硫酸氢根离子(HSO4-)
- 磷酸(H3PO4)
- 亚硝酸(HNO2)
- 氢氟酸(HF)
- 甲烷酸(HCO2H)
- 苯甲酸(C6H5COOH)
- 乙酸(CH3COOH)
- 甲酸(HCOOH)
注意:你不必把强酸和弱酸与浓酸和稀酸混淆。浓酸是指含有少量溶剂(水)的酸,而稀酸是指含有大量溶剂(水)的酸。
关于基地你需要知道什么
碱基特性

- 碱是任何接受质子的物质。
- 碱的末端有一个化学式OH。例如,氢氧化钠(NaOH)和氢氧化钾(KOH)等。
- 碱使酚酞溶液溶解时变成粉红色。
- 碱的强度取决于氢氧化物离子的浓度。
- 碱的性质是肥皂。
- 碱与金属不反应。
- 所有的底座都会把红色的石蕊纸变成蓝色。
- 当碱溶于水时,它们会释放出氢氧化物离子(OH)。
- 所有碱基的PH值都大于7.0,如果碱基较强,PH值可能会上升到14。
- 由于底座和手掌上的油发生反应,底座感觉很滑。
基地类型
碱可分为五类,即强碱、弱碱、超碱、中性碱和固体碱。详情如下。
坚实的基础
强碱是在水溶液中完全解离的碱。这些化合物在水中电离,每个碱分子产生一个或多个氢氧化离子(HO-)。强碱与强酸反应形成稳定的化合物。大多数碱金属和碱土金属氢氧化物在溶液中是强碱。例子包括:
- 氢氧化钠(NaoH)
- 氢氧化钾(KOH)
- 氢氧化锂(LiOH)
- 氢氧化铷(RbOH)
- 氢氧化铯(CsOH)
- 氢氧化钙(Ca(OH)2
- 氢氧化钡(Ba(OH)2
- 氢氧化锶(Sr(OH)2
超级碱基
酰胺、碳负离子和氢氧化物的第1组(碱金属)盐称为超碱。这些化合物不能在水溶液中保存,因为它们是比氢氧化离子更强的碱。超碱性质子水。
中性碱
中性碱是与中性酸形成键的碱。
弱碱
弱碱是一种在水中部分解离的碱,产生的水溶液含有OH离子和一小部分未解离的碱分子。弱碱也可以定义为质子化不完全的化学碱。氨是弱碱的一个很好的例子。
坚实的基础
固体碱可用于阴离子交换树脂或与气态酸反应。它以固体形式活跃。安装在氧化铝上的二氧化硅(SiO2)和NaOH是固体碱的示例。
酸的(acid)和表格形式的基础(base in tabular form)的区别
| 比较基础 | 基础 | 酸的 |
| 布朗斯特德·劳里描述 | 碱是任何接受质子的物质。 | 酸是任何提供质子的物质。 |
| 刘易斯描述 | 碱是一种物质,它提供一对电子(亲核分子),并将有一对孤电子。他称之为刘易斯基地。 | 酸是一种物质,它接受一对电子(亲电试剂),并将有一对孤电子。他称之为路易斯酸。 |
| 阿累尼乌斯描述 | 碱是一种水性物质,它提供电子、接受质子或释放羟基离子(OH)。 | 酸是一种化合物,当溶解在水中时,溶液中的(H˖)离子活性比纯净水高。 |
| PH值(测量溶液中氢离子的浓度) | PH值通常大于7.0,如果碱性较强,PH值可高达14。 | PH值小于7.0 |
| 物理状态 | 通常,碱在室温下以液态和固态存在。只有氨以气体的形式存在,味道是酸的。同时,由于基底和手掌上的油的反应,基底感觉很滑。 | 根据温度的不同,酸可以以固态、气态或液态出现。酸有酸味。 |
| 化学式 | 碱的末端有一个化学式OH。例如,氢氧化钠(NaOH)和氢氧化钾(KOH)等 | 酸的化学式以H开始,例如盐酸(HCL)、硼酸(H3BO3)、硫酸(H2SO4)和碳酸(CH2O3)。尽管也有例外,如CH2COOH和许多其他。 |
| 酚酞 | 碱使酚酞溶液溶解时变成粉红色。 | 当酸溶解在酚酞中时,溶液的合成颜色为无色。 |
| 石蕊试纸 | 所有的底座都会把红色的石蕊纸变成蓝色。 | 所有的酸都能把蓝色的石蕊纸变成红色。 |
| 分解 | 当碱溶于水时,它们会释放出氢氧化物离子(OH)。 | 当酸溶于水时,它们会释放氢离子(H˖)。 |
| 力量 | 强度取决于氢氧化物离子的浓度。 | 强度取决于氢离子的浓度。 |
| 反应性 | 碱与金属不反应。 | 酸与金属反应生成氢气。 |
| 自然界 | 碱的性质是肥皂 | 酸具有腐蚀性。 |
| 使用 | 用于胃药(抗酸剂)、肥皂和洗涤剂、除臭剂、中和土壤酸度、止汗剂 | 制作食品增香苏打水家用清洁皮革加工肥料制造防腐剂 |
| 例子 | 氢氧化铵(NH4OH)、小苏打(碳酸氢钠)、氢氧化钠(NaOH)、氢氧化锂(LiOH)、氢氧化钙(OH)2 | 乙酸乳酸柠檬酸硫酸水杨酸盐酸盐酸盐酸硝酸碳酸 |
什么是酸和碱之间的一些相似之处(some of the similarities between acids and bases)?
- 酸和碱都是电解质,这意味着它们在水相中可以传导电流。
- 酸和碱都与指示剂反应,产生不同的颜色。常用的指示剂是酚酞和石蕊试纸。
- 酸和碱都溶于水。
- 它们彼此形成盐。通常酸和碱之间的反应会产生盐。
- 酸和碱都是化合物。它们由一个或多个元素或原子组成。
- 发表于 2021-11-29 17:15
- 阅读 ( 102 )
- 分类:科学
你可能感兴趣的文章
甲烷酸(methanoic acid)和乙醇酸(ethanoic acid)的区别
...主要区别 2. 什么是甲烷酸 3. 什么是乙醇酸 4. 甲醇和乙醇酸的相似性 5. 并列比较-以表格形式列出的甲烷酸与乙醇酸 6. 摘要 什么是甲基丙烯酸(methanoic acid)? 甲酸,又称甲酸,是最简单的羧酸,含有一个与氢原子键合的羧酸基团...
- 发布于 2020-09-16 21:12
- 阅读 ( 452 )
卡罗酸(caro’s acid)和马歇尔酸(marshall’s acid)的区别
卡罗酸和马歇尔酸的关键区别在于,卡罗酸含有一个硫酸基,而马歇尔酸含有两个硫酸基。 卡罗酸和马歇尔酸是含有硫酸盐基团的无机酸化合物。它们分别命名为过氧一硫酸和过氧二硫酸。顾名思义,这些无机化合物都含有...
- 发布于 2020-09-17 15:34
- 阅读 ( 751 )
酸碱反应(acid base reaction)和沉淀反应(precipitation reaction)的区别
...也可以称之为中和反应。此外,这些反应的最终产物是由酸的阴离子和碱的阳离子加上水分子构成的盐。在这个反应中,键断裂和键形成可能发生。 此外,酸碱反应可以通过两种方式发生:如果反应发生在强酸和强碱之间,那...
- 发布于 2020-10-16 00:01
- 阅读 ( 584 )
弱酸(weak acid)和稀酸(dilute acid)的区别
弱酸和稀酸的关键区别在于,弱酸是一种化合物,当溶解在水中时会部分分解,而稀酸是一种含有比酸更多的水的溶液。 酸是一种能在水中离解释放质子(氢离子)的化合物。因此,酸的pH值低于7。根据酸的强度有强酸和弱...
- 发布于 2020-10-16 18:33
- 阅读 ( 567 )
熏蒸硝酸(fuming nitric acid)和浓硝酸(concentrated nitric acid)的区别
...淡黄色或棕色的烟雾,而浓硝酸通常不形成烟雾;但这种酸的浓度非常高,可能会产生白色烟雾。 硝酸是一种极具腐蚀性和危险性的酸,化学式为HNO3。此外,它可以具有稀释或浓缩的化学性质。不管怎样,它都有硝酸分子溶解...
- 发布于 2020-10-17 23:03
- 阅读 ( 404 )
酸电离常数(acid ionization constant)和碱基电离常数(base ionization constant)的区别
...类之间关系的数值。酸离解常数用Ka表示。它是对溶液中酸的强度的定量测量。酸的强度取决于酸在水溶液中的电离(或解离)。 图01:酸电离示例 酸的离子化可以给出如下公式, 透明质酸+水↔ A–+H3O+ 在这里,HA是一种弱酸,...
- 发布于 2020-10-19 03:06
- 阅读 ( 433 )
二元的(binary)和三元酸(ternary acids)的区别
...具有腐蚀性。因此,使用酸时应小心。二元酸和三元酸是酸的两种形式。二元酸和三元酸的关键区别在于,二元酸是由氢组成的化合物,氢是与非金属键合的基本成分,而三元酸则是含有氢原子和氧原子的酸化合物,大多数情况...
- 发布于 2020-10-24 03:03
- 阅读 ( 419 )
酸的(acid)和基础(base)的区别
酸和碱的关键区别在于酸的pH值在1到7之间,而碱的pH值在7到14之间。 pH值是H+离子浓度的负对数。pH值7被视为中性pH值。pH值高于7表示存在碱,低于7表示存在酸。根据Brønsted-Lowry理论,酸可以释放H+离子,而碱可以接受H+离子...
- 发布于 2020-10-27 05:22
- 阅读 ( 759 )
共轭酸(conjugate acid)和共轭基(conjugate base)的区别
...ted-Lowry理论,酸是质子供体,碱是质子受体。因此,作为酸的分子应该遇到质子受体。另一方面,作为碱基的分子,它应该遇到质子供体。因此,对于酸碱反应,质子给体和受体都应该存在。然而,水可以同时起酸和碱的作用。...
- 发布于 2020-11-05 07:46
- 阅读 ( 970 )
酸的(acid)和酸的(acidic)的区别
...。 酸是pH值小于7的物质,与金属和碱发生反应。另外,酸的一个特点是它们尝起来很酸。然而,酸性这个词是一个形容词,我们用它来描述一种与酸有相似性质的物质的性质。 目录 1. 概述和主要区别 2. 什么是酸 3. 什么是酸性...
- 发布于 2020-11-05 21:23
- 阅读 ( 320 )