电子增益焓(electron gain enthalpy)和电负性(electronegativity)的区别
主差电子增益焓(main difference electron gain enthalpy) vs. 电负性(electronegativity)
电子是原子的亚原子粒子。电子无处不在,因为每种物质都是由原子组成的。然而,在某些化学反应中,电子是非常重要的,因为电子的交换是这些反应中反应物和产物之间的唯一区别。电子增益焓和电负性是用来解释电子与原子结合的两个化学术语。电子增益焓是当一个电子从外部获得时,原子释放的能量。电负性是原子从外部获得电子的能力。因此,电子增益焓量化了电负性。电子增益焓和电负性的主要区别在于电子增益焓是用kJ/mol单位来测量的,而电负性是用Pauling标度来测量的。
覆盖的关键领域
1.什么是电子增益焓-定义、单位、放热和吸热反应2.什么是电负性-定义、测量单位、周期变化3.电子增益焓和电负性之间的差异-主要差异的比较
关键词:原子,电子,电子亲和性,电负性,电子增益焓,吸热,放热,鲍林标度

什么是电子增益焓(electron gain enthalpy)?
电子获得焓是中性原子或分子从外部获得电子时焓的变化。换句话说,它是中性原子或分子(在气相中)从外部获得电子时释放的能量。因此,电子增益焓只是电子亲和性的另一个术语。电子增益焓的测量单位为kJ/mol。
新的电子加成导致一种带负电荷的化学物质的形成。这可以用如下符号表示。
X+e–→ X–+能量
然而,电子增益焓和电子亲和性之间有区别。电子增益焓表示获得电子时释放到周围的能量,而电子亲和性表示获得电子时周围吸收的能量。因此,电子增益焓为负值,而电子亲和力为正值。基本上,这两个术语代表相同的化学过程。

Figure 1: Hydrogen electron configuration is 1s1. It can gain one more electron to fill its electron shell and become stable. Therefore, the electron gain enthalpy is a negative value for this electron gaining.
电子的增益焓让我们知道电子与原子的结合有多强。释放的能量越大,电子的增益焓就越大。电子获得焓的值取决于获得电子的原子的电子构型。把电子加到中性原子或分子上释放能量。这叫做放热反应。这个反应产生负离子。电子增益焓为负值。但是如果另一个电子要加入到这个负离子中,为了继续这个反应,应该给它能量。这是因为入射电子被其他电子排斥。这种现象称为吸热反应。在这里,电子增益焓将是一个正值。
什么是电负性(electronegativity)?
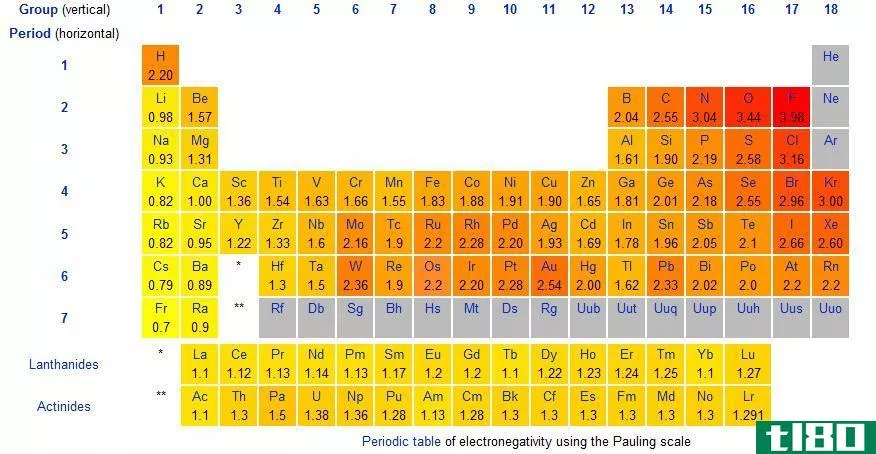
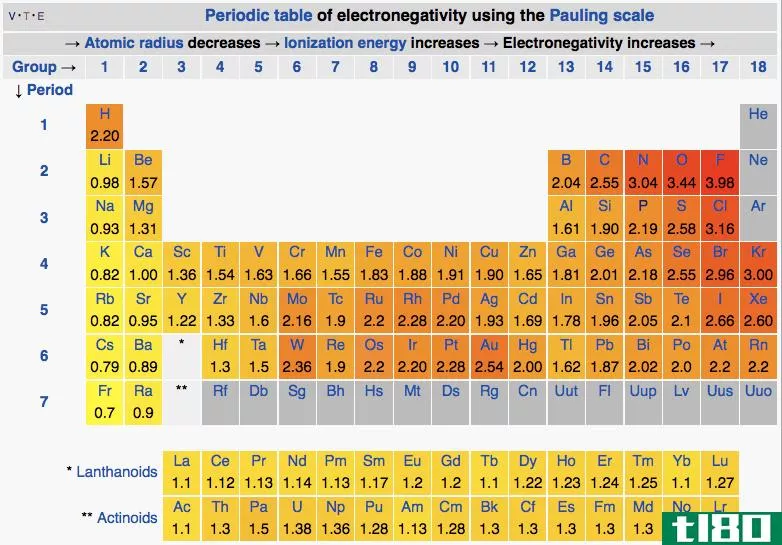
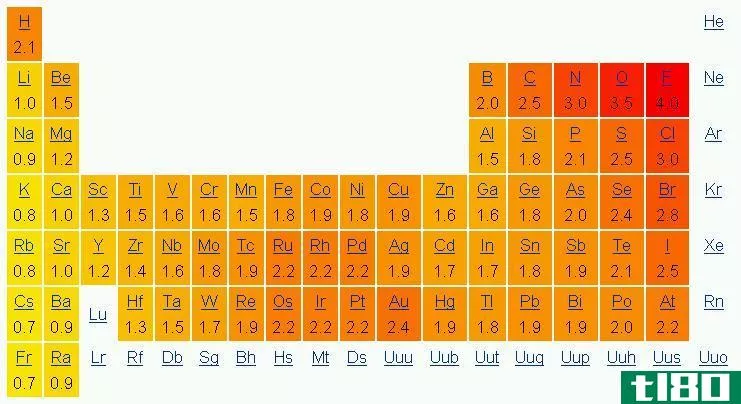
电负性是原子从外部吸引电子的能力。这是原子的定性性质,为了比较每个元素中原子的电负性值,使用了相对电负性值所在的标度。这个尺度被称为“鲍林尺度”,根据这个尺度,原子所能具有的最高电负性值是4.0。考虑到其他原子吸引电子的能力,给出了它们的电负性值。
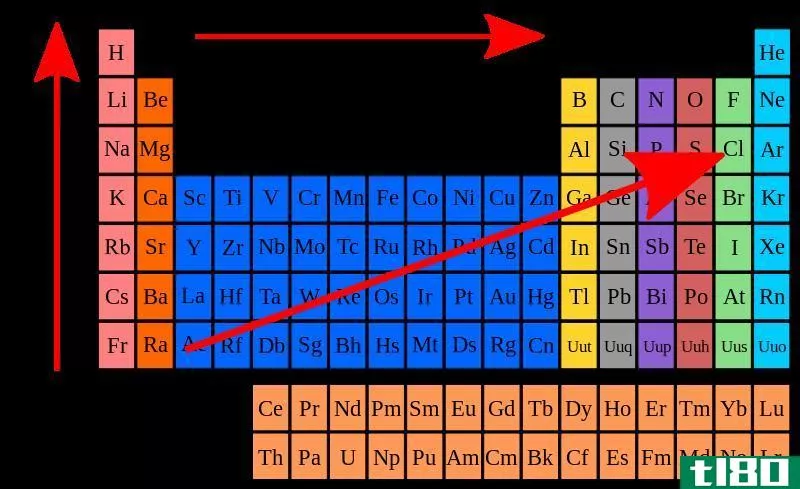
电负性取决于原子序数和元素中原子的大小。当考虑周期表时,氟(F)的电负性为4.0,因为它是一个小原子,价电子位于原子核附近。因此,它可以很容易地从外部吸引电子。另外,氟的原子序数为9;它有一个空位轨道来容纳一个或多个电子,以遵守八位元规则。因此,氟很容易从外面吸引电子。

Figure 2: Allen scale is a different scale used to give the electronegativity of atoms. However, Pauling scale is the generally used scale in which 4.0 is the maximum electronegativity value.
电负性使两个原子之间的键具有极性。如果一个原子的电负性比另一个原子大,那么电负性高的原子可以吸引键上的电子。这使得另一个原子由于周围缺少电子而部分带正电荷。因此,电负性是将化学键分为极性共价键、非极性共价键和离子键的关键。离子键发生在两个原子之间,它们之间的电负性差别很大,而共价键发生在原子之间,原子之间的电负性差别很小。
元素的电负性是周期性变化的。元素周期表根据元素的电负性值对元素进行了更好的排列。当考虑周期表中的一个周期时,每个元素的原子大小从周期的左边到右边递减。这是因为价壳层中的电子数和原子核中的质子数都增加了,因此电子与原子核之间的吸引力逐渐增大。因此,电负性也会随着时间的推移而增加,因为来自原子核的吸引力会增加。这样原子就可以很容易地从外面吸引电子。
电子增益焓(electron gain enthalpy)和电负性(electronegativity)的区别
定义
电子增益焓:电子增益焓是中性原子或分子从外部获得电子时焓的变化。
电负性:电负性是原子从外部吸引电子的能力。
计量单位
电子增益焓:电子增益焓以kJ/mol计。
电负性:电负性是单位少,是衡量保林规模。
测量
电子增益焓:电子增益焓测量能量的大小。
电负性:电负性衡量获得电子的能力。
价值
电子增益焓:电子增益焓可以是正的,也可以是负的,这取决于将要获得电子的原子的电子构型。
电负性:电负性总是正值。
结论
电子获得焓测量原子从外部获得电子时释放的能量。电负性测量原子从外部获得电子的能力。电子增益焓和电负性的主要区别在于电子增益焓是用kJ/mol单位来测量的,而电负性是用Pauling标度来测量的。
引用
1.“电子增益焓-化学,11类,元素分类和性质周期性。”ClassNotes.org.in,2017年3月28日,可在此处获得。2电负性。“化学剧本,剧本,2017年9月29日,可在这里获得。 2.“电负性”,化学剧本,剧本,2017年9月29日,
- 发表于 2021-06-30 00:25
- 阅读 ( 234 )
- 分类:科学
你可能感兴趣的文章
键焓(bond enthalpy)和晶格焓(lattice enthalpy)的区别
键焓和晶格焓的关键区别在于,键焓是分解化学键所需的能量,而晶格能是从气态的阳离子和阴离子形成一摩尔离子化合物所需的能量。 这两个术语都描述了系统与其周围环境之间的能量交换。键焓与晶格焓相反。键焓解释...
- 发布于 2020-10-15 02:15
- 阅读 ( 435 )
电正性(electropositive)和电负性(electronegative)的区别
...因此,我们可以把它分为正负两种元素。 什么是电负性(electronegative)? 电负性是指化学元素获得电子的能力。从外部获得电子形成阴离子;阴离子是带负电的化学物质。电负性与电正性相反。这个现象的符号是χ。这个术语可能...
- 发布于 2020-10-15 13:07
- 阅读 ( 1156 )
自由能(free energy)和焓(enthalpy)的区别
关键区别-自由能与焓 自由能和焓是两个热力学术语,用来解释热能与热力学系统中发生的化学反应之间的关系。自由能或热力学自由能是一个热力学系统能做的功的量。换言之,自由能是热力学系统中进行热力学功的可用能...
- 发布于 2020-10-19 11:40
- 阅读 ( 609 )
电负性(electronegativity)和极性(polarity)的区别
...列比较-电负性与极性的表格形式 5. 摘要 什么是电负性(electronegativity)? 电负性是一个原子吸引键中的电子朝向它的倾向。基本上,这显示了原子与电子的“相似性”。我们可以用鲍林标度来表示元素的电负性。 在周期表中,电...
- 发布于 2020-10-22 10:07
- 阅读 ( 891 )
电负性(electronegativity)和电离能(ionization energy)的区别
...比较-电负性与电离能的表格形式 5. 摘要 什么是电负性(electronegativity)? 电负性是一个原子吸引键中的电子朝向它的倾向。换句话说,这表明了原子对电子的吸引力。我们通常用鲍林标度来表示元素的电负性。 在周期表中,电负...
- 发布于 2020-11-04 14:49
- 阅读 ( 936 )
焓(enthalpy)和熵(entropy)的区别
焓和熵之间的关键区别在于,焓是在恒定压力下发生的热传递,而熵给出了系统随机性的概念。 为了化学研究的目的,我们把宇宙分成两个系统和一个环境。在任何时候,我们要研究的部分是系统,其余的都是围绕着系统。...
- 发布于 2020-11-04 20:59
- 阅读 ( 1860 )
焓(enthalpy)和热(heat)的区别
焓和热之间的关键区别在于,焓是在恒压下化学反应过程中传递的热量,而热是能量的一种形式。 为了研究化学,我们把宇宙分成两个部分:一个系统和一个周围。系统是我们调查的对象,其余的是周围的。热和焓是描述系...
- 发布于 2020-11-05 19:40
- 阅读 ( 875 )
电子亲和力(electron affinity)和电子增益焓(electron gain enthalpy)的区别
...力与电子增益焓的表格形式 5. 摘要 什么是电子亲和力(electron affinity)? 电子亲和力是中性原子或分子(气相中)从外部获得电子时释放的能量。这种获得电子的过程可以形成带负电荷的化学物质。 此外,向中性原子或分子中加...
- 发布于 2021-03-04 15:37
- 阅读 ( 645 )
正电性(electropositive)和电负性自由基(electronegative radicals)的区别
...子(Na+)等。 图01:自由基的形成 什么是电负性自由基(electronegative radicals)? 电负性自由基是能够获得电子并携带负电荷的原子、离子或分子。电负性自由基是由于化学物种的高电负性而形成的,这意味着特定的化学物种有获...
- 发布于 2021-03-04 19:21
- 阅读 ( 991 )
原子化焓(enthalpy of atomisation)和键裂解(bond dissociation)的区别
原子化焓和键离解焓之间的关键区别在于,原子化焓描述了将分子分离成原子所需的能量,而键离解焓描述了分子中化学键的离解。 有时,如果存在简单键,一些简单化合物的原子化焓和键解离焓是相同的。这是因为,在简...
- 发布于 2021-03-04 20:07
- 阅读 ( 940 )