关键区别-自由能与焓
自由能和焓是两个热力学术语,用来解释热能与热力学系统中发生的化学反应之间的关系。自由能或热力学自由能是一个热力学系统能做的功的量。换言之,自由能是热力学系统中进行热力学功的可用能量。另一方面,焓是一个热力学量,代表一个热力学系统的总能量含量。自由能和焓的关键区别在于,自由能给出了进行热力学功的总能量,而焓给出了一个热力学系统可以转化为热能的总能量。
目录
1. 概述和主要区别
2. 什么是自由能
3. 什么是焓
4. 自由能与焓的关系
5. 并列比较-自由能与焓的表格形式
6. 摘要
什么是自由能(free energy)?
自由能是热力学系统进行热力学功的可用能量。自由能有能量的维度。热力学系统的自由能值是由系统的当前状态决定的,而不是由它的历史决定的。热力学中经常讨论两种主要的自由能:亥姆霍兹自由能和吉布斯自由能。
亥姆霍兹自由能
亥姆霍兹自由能是在封闭的热力学系统中,在恒定的温度和体积下进行热力学功的能量。因此,Helmholtz能量的负值表示热力学系统通过保持其体积常数所能完成的最大功。为了保持体积不变,一些总的热力学功作为边界功来做(保持系统的边界不变)。亥姆霍兹能量方程如下所示。
A=U–TS
其中A是亥姆霍兹自由能,U是内能,T是温度,它是常数,S是系统的熵。熵是一个热力学量,表示系统的热能不能转化为机械功。

图01:Hermann von Helmholtz是第一个提出亥姆霍兹自由能概念的人
吉布斯自由能:
吉布斯自由能:在一个封闭的,热力学系统中,在恒定的温度和压力下进行热力学功的能量。系统的音量可能会有所不同。自由能用G表示。吉布斯自由能方程如下所示。
G=H–TS
在上面的方程中,G是吉布斯自由能,H是系统的焓,Y是温度,这是一个常数,S是系统的熵。
什么是焓(enthalpy)?
一个系统的焓是一个相当于系统总热含量的热力学量。它等于系统的内能加上压力和体积的乘积。因此,它是一个系统的热力学性质。焓方程如下所示。
H=U+PV
因此,H是系统的焓,U是系统的内能,P是压力,V是体积。系统的焓是系统释放热量(做非机械功)的能力的指标。焓用符号H表示。
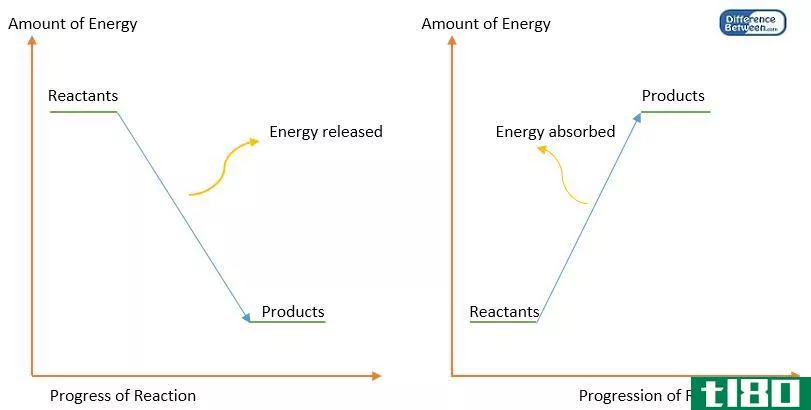
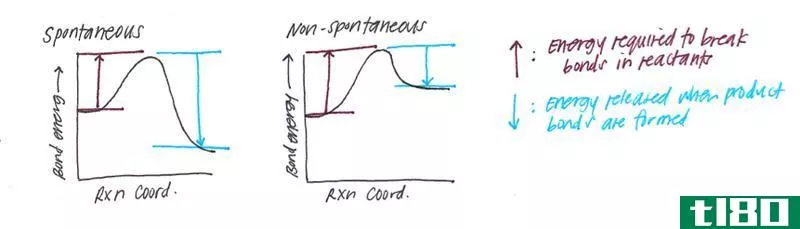
确定系统的焓,可以指示化学反应是放热的还是吸热的。系统焓的变化可以用来确定反应的热,也可以预测化学反应是自发的还是非自发的。
什么是自由能与焓的关系(the relati***hip between free energy and enthalpy)?
吉布斯自由能和焓通过下面的方程联系起来。
G=H–TS
在上面的方程中,G是吉布斯自由能,H是系统的焓,Y是温度,这是一个常数,S是系统的熵。G和H的测量单位相同。
自由能(free energy)和焓(enthalpy)的区别
| 自由能与焓 | |
| 自由能是热力学系统进行热力学功的可用能量。 | 一个系统的焓是一个相当于系统总热含量的热力学量。 |
| 概念 | |
| 自由能给出了进行热力学功的总能量。 | 焓表示一个系统可以转化为热能的总能量。 |
| 转换 | |
| 自由能是指能转化为系统机械功的能量。 | 焓给出能转化为系统非机械功的能量。 |
总结 - 自由能(free energy) vs. 焓(enthalpy)
热力学系统的自由能和焓表示系统中可用的能量。自由能和焓的关键区别在于,自由能给出了进行热力学功的总能量,而焓给出了一个系统可以转化为热能的总能量。
引用
1.大英百科全书的编辑。“自由能源”,《大英百科全书》,大英百科全书,2012年1月5日。这里有2。赫尔曼斯汀,安妮·玛丽,D.“什么是化学和物理中的焓?”?“ThoughtCo,2018年1月25日。可在此处查阅3。”Helmholtz free energy,维基百科,维基媒体基金会,2018年2月17日。可在此处查阅4。“Gibbs(自由)能源”。《化学LibreTexts》,LibreTexts,2018年1月12日。此处提供
2.赫尔曼斯汀,安妮·玛丽,D.“化学和物理中的焓是什么?”?“ThoughtCo,2018年1月25日
3.“赫尔姆霍兹自由能源”,维基百科,维基媒体基金会,2018年2月17日
4.“吉布斯(自由)能源”,《化学LibreTexts》,歌词,2018年1月12日。