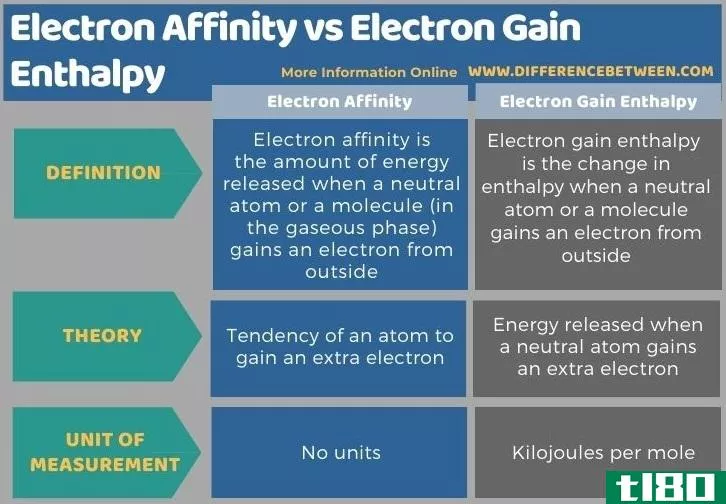
电子亲和力和电子增益焓的关键区别在于,电子亲和力是指孤立原子获得电子的趋势,而电子增益焓是指孤立中性原子获得一个额外电子时释放的能量。
电子亲和力和电子增益焓是两个相关的术语,因为电子增益焓是关于电子亲和力的测量。
目录
1. 概述和主要区别
2. 什么是电子亲和力
3. 什么是电子增益焓
4. 并排比较-电子亲和力与电子增益焓的表格形式
5. 摘要
什么是电子亲和力(electron affinity)?
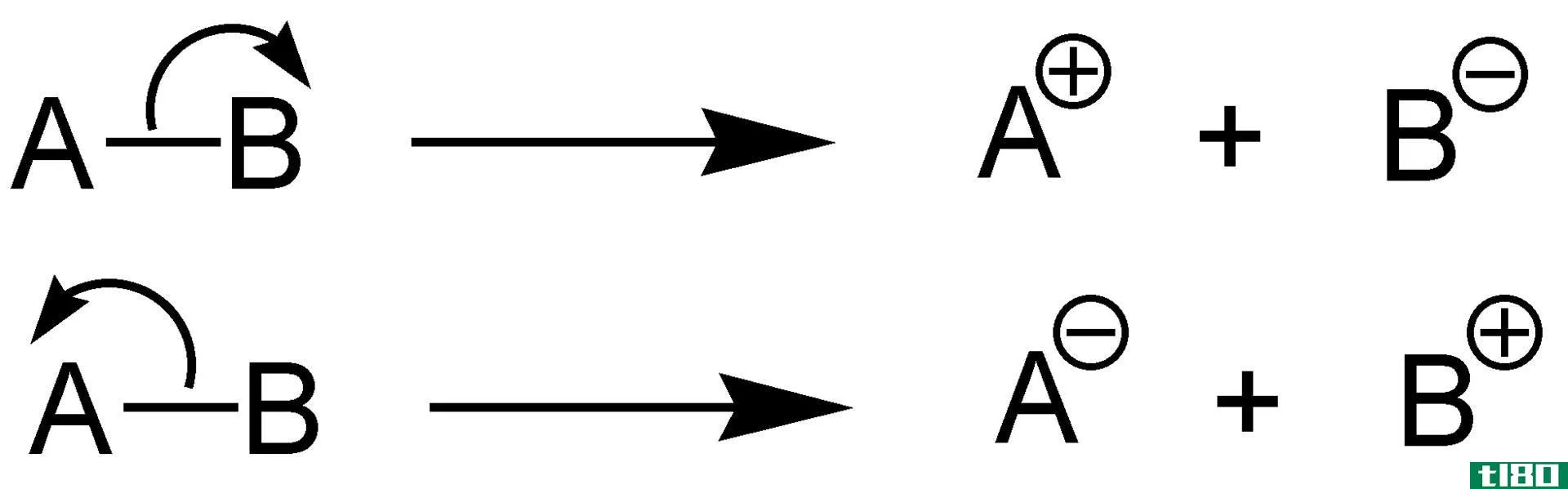
电子亲和力是中性原子或分子(气相中)从外部获得电子时释放的能量。这种获得电子的过程可以形成带负电荷的化学物质。
此外,向中性原子或分子中加入一个电子会释放能量。我们可以称之为放热反应。这种反应产生负离子。然而,如果另一个电子要加入到这个负离子中,就应该给它能量,以便继续这个反应。这是因为入射电子被其他电子排斥。这种现象称为吸热反应。
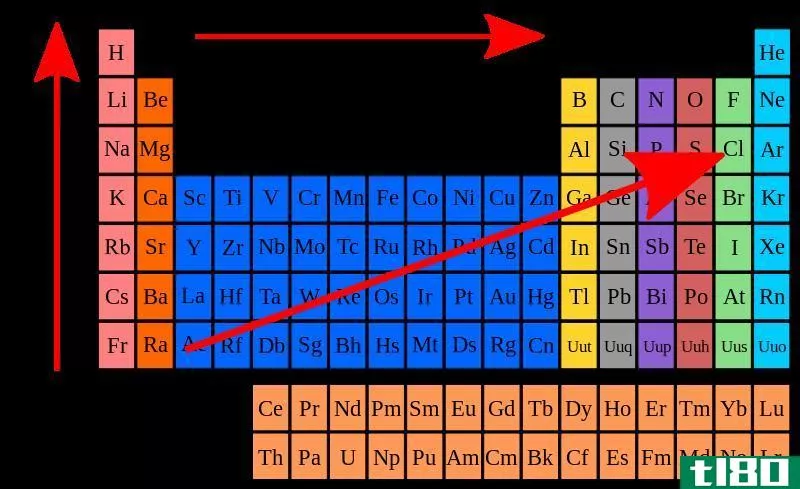
同一物种的第一电子亲和性为负值,第二电子亲和性为正值。
电子亲和力在周期表中显示出周期性的变化。这是因为入射电子被加到原子的最外层轨道上。元素周期表的元素是按照原子序数的升序排列的。当原子序数增加时,它们最外层轨道上的电子数增加。
一般来说,电子亲和力应该沿着从左到右的周期增加,因为电子的数量沿着一个周期增加;因此,很难添加新的电子。当实验分析时,电子亲和势值显示出之字形图案而不是显示出逐渐增加的图案。
什么是电子增益焓(electron gain enthalpy)?
电子获得焓是中性原子或分子从外部获得电子时焓的变化。我们可以说它是中性原子或分子(在气相中)从外部获得电子时释放的能量。因此,电子增益焓是我们用来表示电子亲和性的另一个术语。测量电子增益焓的单位是kJ/mol。新的电子加成会形成带负电的化学物质。
然而,电子增益焓和电子亲和性之间有区别。电子获得焓表示获得电子时释放到周围的能量,而电子亲和性表示获得电子时周围吸收的能量。因此,电子增益焓为负值,而电子亲和力为正值。基本上,这两个术语代表相同的化学过程。
电子增益焓给了我们一个关于电子与原子结合强度的概念。释放的能量越大,电子的增益焓就越大。
电子获得焓的值取决于获得电子的原子的电子构型。把电子加到中性原子或分子上释放能量。这叫做放热反应。这个反应产生负离子。电子增益焓为负值。但是如果另一个电子要加入到这个负离子中,为了继续这个反应,应该给它能量。这是因为入射电子被其他电子排斥。这种现象称为吸热反应。在这里,电子增益焓将是一个正值。
电子亲和力(electron affinity)和电子增益焓(electron gain enthalpy)的区别
电子亲和力是中性原子或分子(气相中)从外部获得电子时释放的能量。电子获得焓是中性原子或分子从外部获得电子时焓的变化。电子亲和力和电子增益焓之间的关键区别在于,电子亲和力是指孤立原子获得电子的趋势,而电子增益焓是指孤立中性原子获得一个额外电子时释放的能量。
下面以表格形式总结了电子亲和力和电子增益焓之间的差异。
总结 - 电子亲和力(electron affinity) vs. 电子增益焓(electron gain enthalpy)
电子亲和力和电子增益焓是两个相关的术语,因为电子增益焓是关于电子亲和力的测量。电子亲和力和电子增益焓的关键区别在于,电子亲和力是指孤立原子获得电子的趋势,而电子增益焓是指孤立中性原子获得一个额外电子时释放的能量。
引用
1“电子亲和力”,化学剧本,剧本,2020年9月26日,可在这里获得。