熵(entropy)和焓(enthalpy)的区别
主差熵(main difference entropy) vs. 焓(enthalpy)
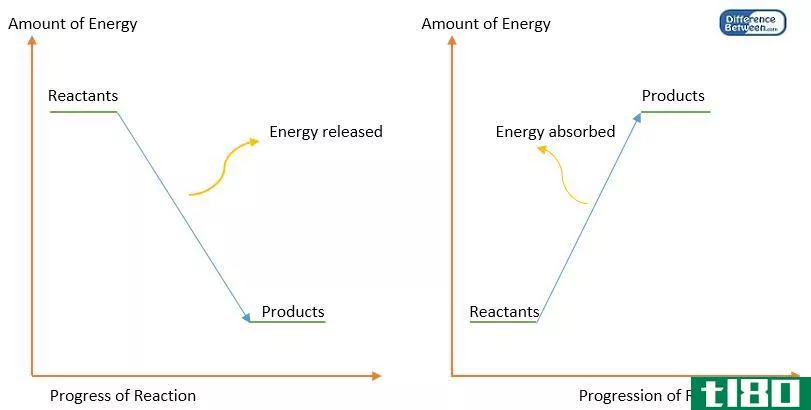
在化学热力学中,熵和焓都与测量函数有关。而且它们都与反应的热变化有关。熵和焓的主要区别是,熵用来衡量化学过程的无序性或随机性,而焓用来衡量化学反应的热变化或恒压下反应的内能变化。
什么是熵(entropy)?
如上所述,熵度量化学过程中的随机性或无序程度。根据热力学第二定律,认为孤立系统的熵总是增加的。这意味着化学反应将倾向于把自己推向更无序的方向。这是一个过程变得稳定的时候。反应的随机性或无序性随着分子数量的增加而增加。因此,如果一个反应的产物中分子的数量比反应物中分子的数量多,则可以得出结论,反应正朝着更高的无序度发展,这是化学中的一个有利条件。
熵在化学中被认为是一种状态函数,因为熵的变化不依赖于从反应物到产物的化学路径。它只取决于反应的开始点和结束点。熵用“S”来表示,由于它是一个状态函数,所以总是用大写字母来表示。熵的变化写为ΔS'。熵在数学上可以表示为热变化和温度变化之间的除法。然而,化学过程可以是可逆的,也可以是不可逆的。可逆过程中的热变化是导出熵方程时要考虑的,因为它涉及到最大的传热。化学反应过程中熵的总变化是产物熵和反应物熵之间的差值。熵可以用单位JK-1来度量。

Rudolf Clausius is the originator of the concept of entropy
什么是焓(enthalpy)?
焓的变化与反应的热变化有关,当反应在恒压下发生时,它代表了反应体系的内能变化。直接测量焓没有什么意义,而焓的变化才是有意义的。焓也是一个状态函数,这意味着该值不会因获得产品所采用的化学途径而改变。因为它是一个状态函数,所以用大写字母表示,在这种情况下,它是‘H’,焓的变化被标记为’ΔH’。反应焓的总变化是产物焓和反应物焓之差。焓的单位是Jmol-1。
只有在标准条件下发生反应时,反应的热变化才称为焓。即压力为1巴,指定温度通常为25℃°C.存在许多类型的反应焓。i、 反应焓、生成焓、燃烧焓、中和焓、溶解焓等。

Josiah Willard Gibbs’ theories were the earliest writings to contain the concept of enthalpy.
熵(entropy)和焓(enthalpy)的区别
定义
熵是化学过程随机性或无序程度的度量。
焓是在恒定压力下发生的反应热变化的量度。
测量单位
熵在JK-1中测量
焓用Jmol-1表示
要求
熵没有任何要求或限制,它的变化是通过化学过程的热变化和温度的划分来衡量的。
相比之下,焓只能与标准条件下反应的热变化有关。
Image Courtesy:
“Clausius” by Original uploader was user: Sadi Carnot – (Public Domain) via Comm***
“约西亚威拉德吉布斯-从彩信-”未知。上传人:Serge Lachinov(обработка для wiki)–J。威拉德·吉布斯,两卷,H。A.Bumstead和R。G。货车名称,(伦敦和纽约:朗曼,格林公司,1906年)(公共领域)
- 发表于 2021-06-27 08:16
- 阅读 ( 1259 )
- 分类:科学
你可能感兴趣的文章
键能(bond energy)和键焓(bond enthalpy)的区别
关键区别-键能与键焓 键能和键焓都描述了同一个化学概念:将一摩尔分子分解成其组成原子所需的能量。它测量化学键的强度。所以也叫粘结强度。键能计算为气相化学物质在298K下的键离解能的平均值。键能和键焓这两个...
- 发布于 2020-09-24 09:39
- 阅读 ( 876 )
构型熵(configurational entropy)和热熵(thermal entropy)的区别
构型熵和热熵的关键区别在于,构型熵是指在没有温度交换的情况下所做的功,而热熵是指在温度交换的情况下所做的功。 在这里,熵是一个热力学系统随机性的度量。随机性的增加是指熵的增加,反之亦然。 目录 1. 概述...
- 发布于 2020-09-26 17:30
- 阅读 ( 1564 )
键焓(bond enthalpy)和晶格焓(lattice enthalpy)的区别
键焓和晶格焓的关键区别在于,键焓是分解化学键所需的能量,而晶格能是从气态的阳离子和阴离子形成一摩尔离子化合物所需的能量。 这两个术语都描述了系统与其周围环境之间的能量交换。键焓与晶格焓相反。键焓解释...
- 发布于 2020-10-15 02:15
- 阅读 ( 435 )
自由能(free energy)和焓(enthalpy)的区别
关键区别-自由能与焓 自由能和焓是两个热力学术语,用来解释热能与热力学系统中发生的化学反应之间的关系。自由能或热力学自由能是一个热力学系统能做的功的量。换言之,自由能是热力学系统中进行热力学功的可用能...
- 发布于 2020-10-19 11:40
- 阅读 ( 609 )
周期性(cyclic)和可逆过程(reversible process)的区别
...功等于气体所做的功。此外,在循环过程中,系统的内能和焓变均为零。 可逆过程:在可逆过程中,系统彼此处于热力学平衡状态。因此,该过程应该发生在无穷小的时间内,并且系统的热含量在过程。因此,系统的熵保持不...
- 发布于 2020-10-22 18:27
- 阅读 ( 311 )
绝热的(adiabatic)和等熵过程(isentropic processes)的区别
绝热过程和等熵过程的关键区别在于绝热过程可以是可逆的,也可以是不可逆的,而等熵过程是可逆的。 在化学中,我们把宇宙分成两部分。我们感兴趣的部分是一个系统,其余部分是周围环境。一个系统可以是一个有机体...
- 发布于 2020-10-23 09:13
- 阅读 ( 1527 )
状态函数(state function)和路径函数(path function)的区别
状态函数(state function)和路径函数(path function)的区别 热力学是物理化学的一个重要分支,它揭示了不同形式的能量和功之间的热化学关系。有四个热力学定律用于描述热力学系统的行为。状态函数和路径函数是表示系统不同热...
- 发布于 2020-10-24 02:43
- 阅读 ( 1412 )
焓(enthalpy)和熵(entropy)的区别
焓和熵之间的关键区别在于,焓是在恒定压力下发生的热传递,而熵给出了系统随机性的概念。 为了化学研究的目的,我们把宇宙分成两个系统和一个环境。在任何时候,我们要研究的部分是系统,其余的都是围绕着系统。...
- 发布于 2020-11-04 20:59
- 阅读 ( 1860 )
焓(enthalpy)和热(heat)的区别
焓和热之间的关键区别在于,焓是在恒压下化学反应过程中传递的热量,而热是能量的一种形式。 为了研究化学,我们把宇宙分成两个部分:一个系统和一个周围。系统是我们调查的对象,其余的是周围的。热和焓是描述系...
- 发布于 2020-11-05 19:40
- 阅读 ( 874 )
电子亲和力(electron affinity)和电子增益焓(electron gain enthalpy)的区别
电子亲和力和电子增益焓的关键区别在于,电子亲和力是指孤立原子获得电子的趋势,而电子增益焓是指孤立中性原子获得一个额外电子时释放的能量。 电子亲和力和电子增益焓是两个相关的术语,因为电子增益焓是关于电...
- 发布于 2021-03-04 15:37
- 阅读 ( 644 )