主要区别
热力学是物理学的一个分支,研究热和其他相关现象。这也涉及热与其他形式的能量的关系,如电能、机械能或化学能。熵和焓是与热力学有关的著名术语。熵是系统在化学过程中无序或随机性的量度,而焓则是在恒压下化学反应过程中系统的热变化或内能变化。实际上,焓是系统总能量的量度,尽管它总是表示在恒压下能量系统的变化,因为它不能测量系统的总焓。它的单位是焦耳每千克。另一方面,熵是随机活动的度量,通常是系统中无序的数量。熵的国际单位制是焦耳每开尔文(J/K)。
比较图
什么是熵?
熵是系统在化学过程中无序性或随机性的度量。实际上,它是对随机活动的度量,通常是系统中无序的数量。正如我们所知,一个物体的能量决定了它做功的能力,一个物体的能量可以是任何类型的。它可以是机械、化学、热能、核能或任何其他能源。在化学过程中能量或无序度的变化的量度是熵。“S”表示熵,它总是用大写字母写的。在方程中,它被写成“ΔS”,因为它代表了化学过程中熵的无序。熵的国际单位制是焦耳每开尔文(J/K)。熵方程中的温度是在绝对温标或开尔文温标上测量的。
什么是焓?
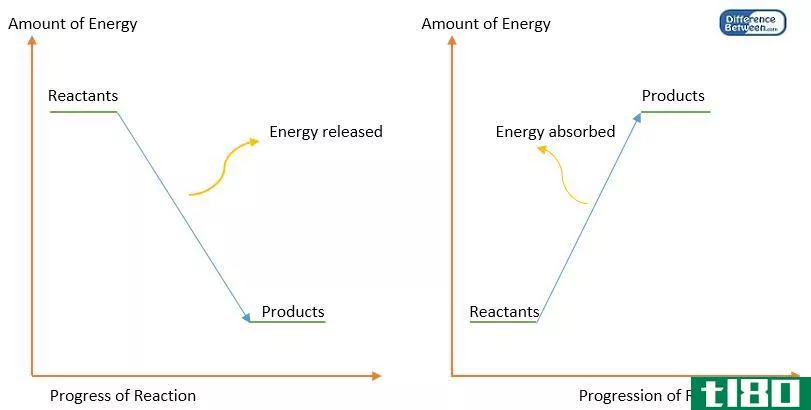
焓是指在恒压下化学反应过程中系统的热变化或内能变化。焓是系统总能量的量度,但由于系统总焓无法测量,所以它总是表示能量系统在恒压下的变化。焓表示为“ΔH”,它表示产物的焓和反应物的焓之间的差异。以Jmol-1为单位进行测量。“焓”这个词来源于希腊语单词“焓”,意思是“把热量放进去”。“焓”这个词是由19世纪著名物理学家海克·卡默林·奥尼斯发明的。一般以焦耳每千克为单位。
熵与焓
- 熵是系统在化学过程中无序或随机性的量度,而焓则是在恒压下化学反应过程中系统的热变化或内能变化。
- 实际上,焓是系统总能量的量度,而熵是随机活动的量度,通常是系统中无序度的大小。
- “焓”这个词是19世纪著名物理学家海克·卡默林·奥尼斯创造的,而德国物理学家鲁道夫·克劳修斯则创造了“熵”这个词
解说视频