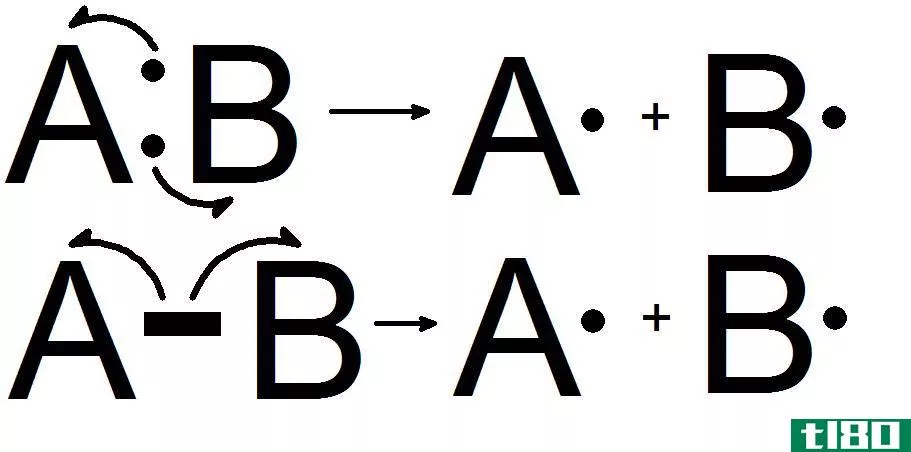键离解能定义
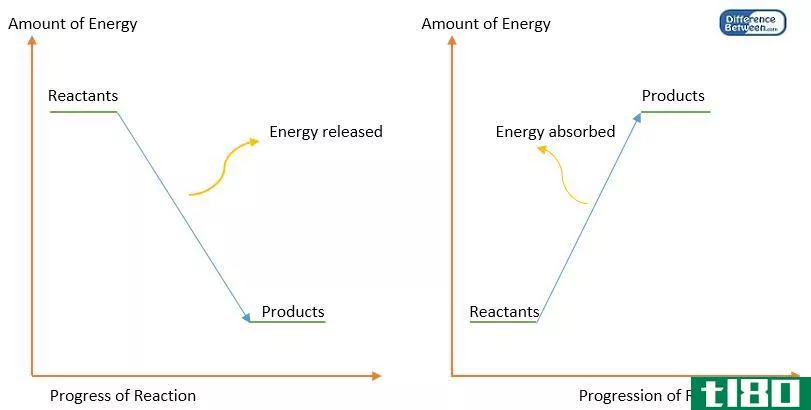
键离解能定义为均匀断裂化学键所需的能量。均质破裂通常产生自由基。该能量的简写符号为BDE、D0或DH°。键离解能通常被用来衡量化学键的强度,并用来比较不同的键。注:焓变化取决于温度。键离解能的典型单位为kJ/mol或kcal/mol。可使用光谱法、量热法和电化学方法通过实验测量键离解能。

关键收获:键离解能
- 键离解能是破坏化学键所需的能量。
- 这是一种量化化学键强度的方法。
- 只有双原子分子的键离解能等于键能。
- 最强的键离解能是Si-F键。共价键的能量最弱,与分子间作用力的强度相当。
键离解能与键能
对于双原子分子,键离解能仅等于键能。这是因为键离解能是单个化学键的能量,而键能是分子内某一类型所有键的所有键离解能的平均值。
例如,考虑从甲烷分子中去除连续的氢原子。第一个键离解能是105 kcal/mol,第二个是110 kcal/mol,第三个是101 kcal/mol,最后一个是81 kcal/mol。因此,键能是键离解能的平均值,或99 kcal/mol。事实上,键能并不等于甲烷分子中任何C-H键的键离解能!
最强和最弱的化学键
根据键离解能,可以确定哪些化学键最强,哪些最弱。最强的化学键是Si-F键。F3Si-F的键离解能为166 kcal/mol,而H3Si-F的键离解能为152 kcal/mol。认为Si-F键如此强的原因是两个原子之间存在显著的电负性差异。
乙炔中的碳-碳键也具有160 kcal/mol的高键离解能。中性化合物中最强的键在一氧化碳中为257 kcal/mol。
因为弱共价键实际上具有与分子间作用力相当的能量,所以没有特别弱的键离解能。一般来说,惰性气体和过渡金属碎片之间的化学键最弱。测得的最小键离解能是氦二聚体He2中原子之间的离解能。二聚体通过范德华力结合在一起,其键离解能为0.021 kcal/mol。
键离解能与键离解焓
有时术语“键离解能”和“键离解焓”可以互换使用。然而,这两者并不一定相同。键离解能是0 K时的焓变。键离解焓,有时简称键焓,是298 K时的焓变。
键离解能有利于理论工作、模型和计算。键焓用于热化学。请注意,在大多数情况下,两种温度下的值没有显著差异。因此,即使焓确实取决于温度,忽略这种影响通常不会对计算产生很大影响。
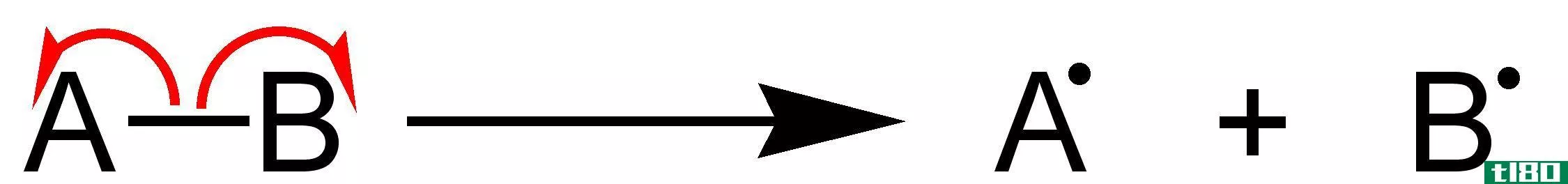
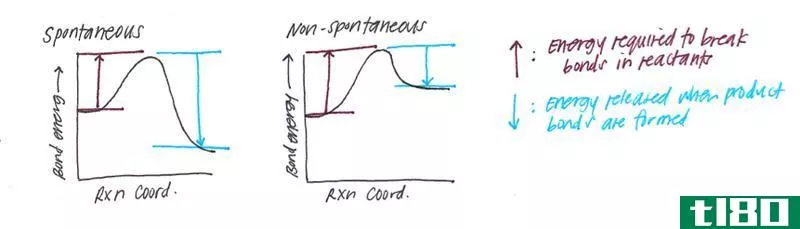
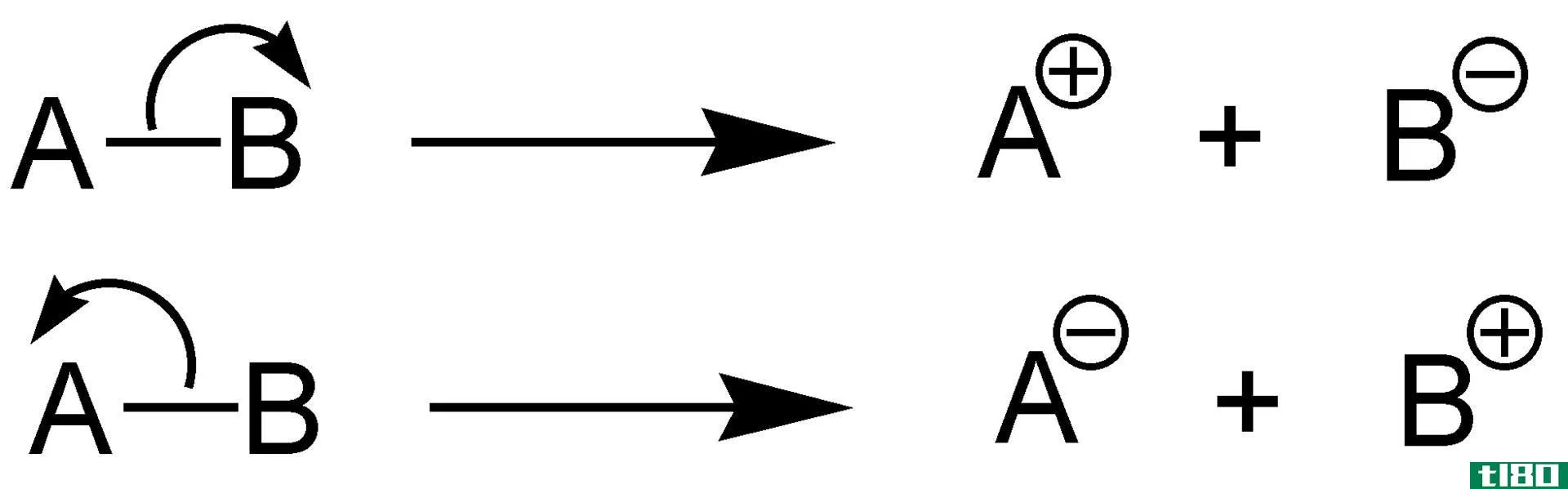
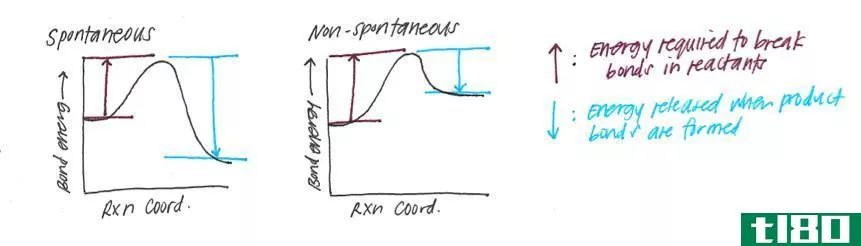
均裂和异裂解离
键离解能的定义是指均匀断裂的键。这是指化学键的对称断裂。然而,键可以不对称地或非对称地断裂。在气相,异相裂解释放的能量大于均相裂解释放的能量。如果存在溶剂,能量值会急剧下降。
来源
- 布兰克斯比,S.J。;埃里森,G.B.(2003年4月)。“有机分子的键离解能”。化学研究报告。36 (4): 255–63. 内政部:10.1021/ar020230d
- IUPAC,《化学术语简编》,第二版(“黄金书”)(1997年)。
- Gillespie,Ronald J.(1998年7月)。共价和离子分子:为什么BeF2和AlF3是高熔点固体,而BF3和SiF4是气体。化学教育杂志。75 (7): 923. 内政部:10.1021/ed075p923
- 罗伯特·凯列斯基;克拉卡,埃尔菲;克雷默,迪特尔(2013)。“化学中最强键的识别”。《物理化学杂志》A.117(36):8981-8995。内政部:10.1021/jp406200w
- 罗耀荣(2007)。化学键能综合手册。博卡拉顿:华润出版社。ISBN 978-0-8493-7366-4。
- 发表于 2021-09-23 23:04
- 阅读 ( 561 )
- 分类:科学
你可能感兴趣的文章
键能(bond energy)和键焓(bond enthalpy)的区别
...以也叫粘结强度。键能计算为气相化学物质在298K下的键离解能的平均值。键能和键焓这两个词之间没有很大的区别,但键能用“E”表示,而键焓用“H”表示。 目录 1. 概述和主要区别 2. 什么是键能 3. 什么是键焓 4. 并列比较-以...
- 发布于 2020-09-24 09:39
- 阅读 ( 887 )
合成反应(synthesis reaction)和离解反应(dissociation reaction)的区别
...过两种或两种以上反应物的组合形成一种新的化合物,而离解反应是将一种化合物分解成两种或两种以上的组分。 合成反应和解离反应是对立的。合成反应描述了一种新化合物的形成,而离解反应描述了一种化合物分解成它的...
- 发布于 2020-10-12 06:07
- 阅读 ( 485 )
键焓(bond enthalpy)和晶格焓(lattice enthalpy)的区别
...变。由于这个术语涉及键断裂,我们也可以将其命名为键离解能。其他同义词包括键强度和平均键能。 图01:一些化学键的键能 如果键的焓值很高,说明键很强,很难分解。因此,它需要更多的能量来分解这种特殊的键。通常...
- 发布于 2020-10-15 02:15
- 阅读 ( 444 )
均裂的(homolytic)和异溶裂变(heterolytic fission)的区别
...的裂变中,每个碎片都得到一个未成对的电子。当这种键离解发生在电子数为偶数的中性分子中时,就会形成两个相等的自由基。 图01:均裂裂变 均裂键离解能是指在此过程中吸收或释放的能量。然而,这种裂变只在特定条件...
- 发布于 2020-10-18 01:00
- 阅读 ( 535 )
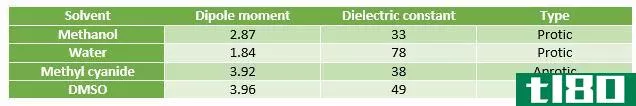
原生的(protic)和非质子溶剂(aprotic solvents)的区别
...子溶剂和非质子溶剂的关键区别在于,质子溶剂中含有可离解的氢原子,而非质子溶剂则没有离解氢原子。 溶剂是一种能溶解其他物质的液体化合物。有不同形式的溶剂,基本上可分为极性溶剂和非极性溶剂两大类。极性溶剂...
- 发布于 2020-10-19 03:54
- 阅读 ( 1197 )
均裂的(homolytic)和异溶键离解能(heterolytic bond dissociation energy)的区别
关键区别-均裂和异溶键离解能 键离解能是化学键强度的量度。键可以以均裂方式或异溶方式解离。键离解能是指化学键经均裂而发生的标准焓变。均溶键离解能是通过溶血分解化学键所需的能量,而异溶键离解能是通过异构...
- 发布于 2020-10-19 07:36
- 阅读 ( 343 )
键能(bond energy)和键离解能(bond dissociation energy)的区别
键能和键离解能的关键区别在于键能是一个平均值,而键离解能是一个特定键的特定值。 正如美国化学家G.N.Lewis提出的那样,当原子的价壳层中含有8个电子时,原子是稳定的。大多数原子的价壳层中的电子少于8个(周期表...
- 发布于 2020-10-21 13:16
- 阅读 ( 778 )
双键(double bond)和单一债券(single bond)的区别
...个区别。也就是说,单键的长度比双键的长。此外,双键离解能相对高于单键离解能。 总结 - 双键(double bond) vs. 单一债券(single bond) 双键和单键是共价化学键的类型。双键和单键的关键区别在于,在单键形成中,两个原子之间...
- 发布于 2020-10-26 19:01
- 阅读 ( 389 )
原子化焓(enthalpy of atomisation)和键裂解(bond dissociation)的区别
原子化焓和键离解焓之间的关键区别在于,原子化焓描述了将分子分离成原子所需的能量,而键离解焓描述了分子中化学键的离解。 有时,如果存在简单键,一些简单化合物的原子化焓和键解离焓是相同的。这是因为,在简...
- 发布于 2021-03-04 20:07
- 阅读 ( 951 )
苄基(benzyl)和苯基(phenyl)的区别
...。苄基位置的特点是反应活性增强。这是由于苄基C的低离解能所致−H债券。苄基C-H键离解所需的能量为90kcal/mol,而甲基C-H键离解所需的能量为90kcal/mol−氢键是105千卡/摩尔,对于乙基C−氢键是101千卡/摩尔。 芳香环对苄基有稳...
- 发布于 2021-06-25 18:46
- 阅读 ( 271 )