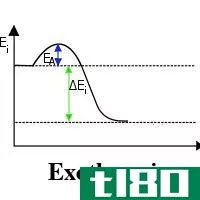
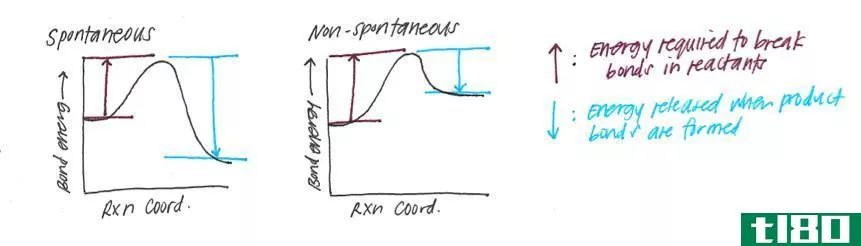
什么是键的焓?(bond enthalpy?)

键焓是热力学研究中的一个术语,指的是打破分子内任何两个原子之间形成的化学键所需的能量。由于化学反应中的化学键强度各不相同,《键焓表》中的键焓值是以平均数的形式给出的。通常,这些数值以kJ/mol表示,尽管它们有时以kJ mol-1出现。由于该值可用于确定化学反应中预期发生的热交换,它有时可与键解离焓和键解离能等术语互换使用。

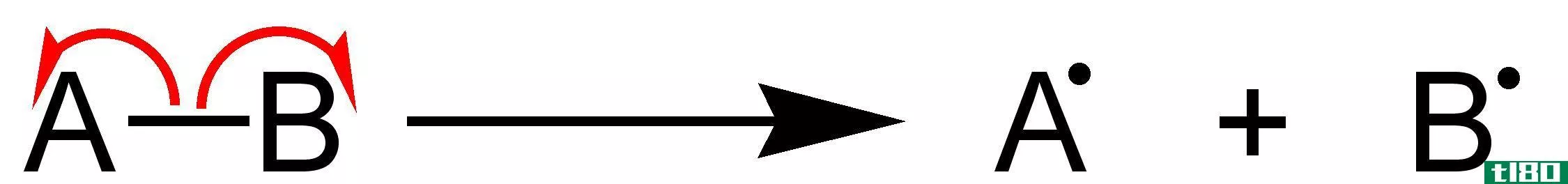
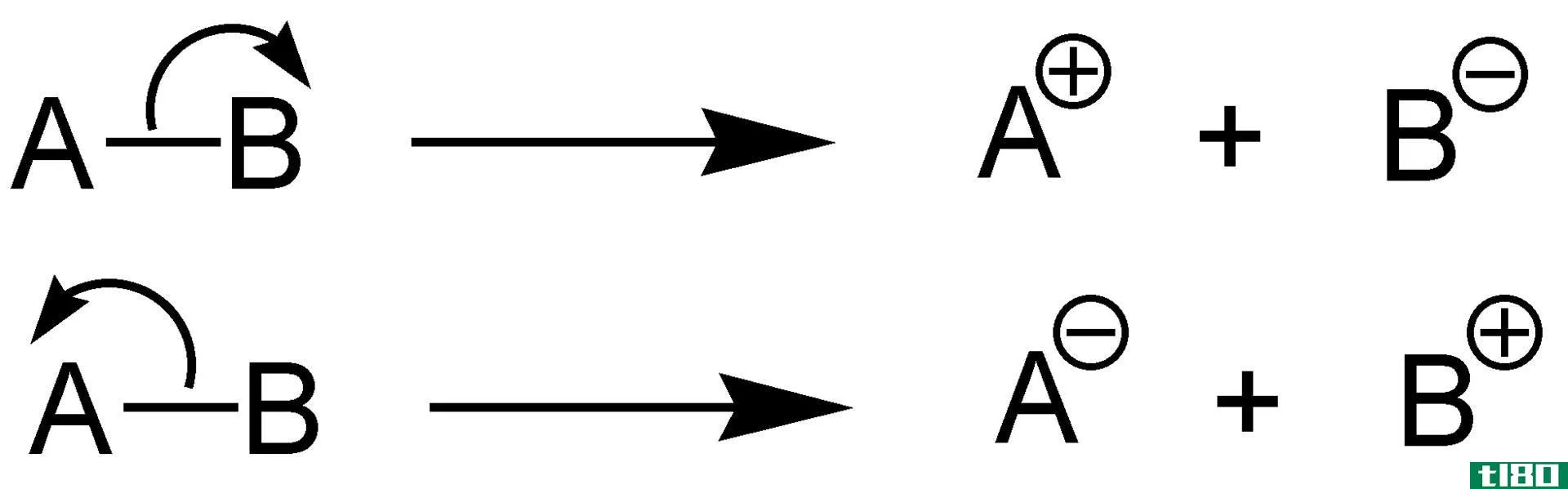
化学键的断裂以不同方式发生。导致阴离子(带负电的离子)和阳离子(带正电的离子)的中性分子的裂变或劈裂是通过异质裂解发生的。相反,如果破坏分子的键导致两个未配对的电子,或自由基,那么这个过程是通过同质裂变开始的。
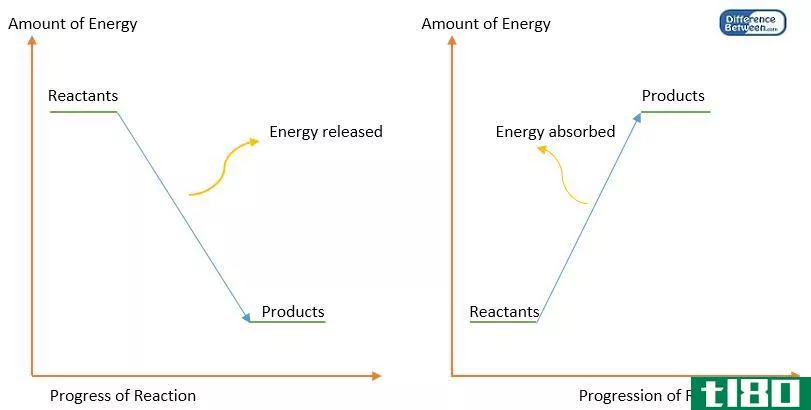
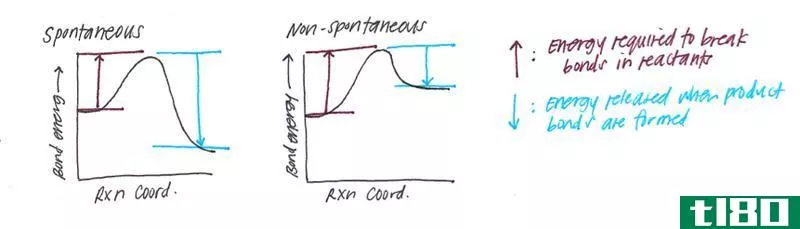
在分子化学中,键焓也指系统内热力学反应的概率。这种可能性要考虑的变量之一当然是键的强度。一般来说,最强的键是在最短的形成中发现的,因为涉及的分子较少。此外,为了使反应是内热的,系统必须接受能量。否则,随着能量的损失,该反应将被定义为放热,并将产生一个焓值较低的新键。
鉴于上述情况,也可以说,键焓代表储存在化学键中的能量量。事实上,当化学反应发生时发生的热交换或能量转移,可以通过用形成键所需的能量减少键焓值来计算。考虑到一个化合物的化学方程式,焓是一个发生在方程式的反应物一侧的内热过程。与此相反,放热反应,或产生化学键所需的能量,则在方程式的产物侧表示。
然而,除非是一个封闭系统,否则一个系统的总焓值无法精确确定。由于极少有系统是完全孤立存在的,因此要计算系统内的焓变。这种变化的方向取决于化学反应是内热的还是外热的。在前者中,焓变是由进入系统的能量量来衡量的,而在后者中则由释放的能量量来衡量。两种反应中的焓变值都是相同的,并表示为+V或-V。
- 发表于 2022-02-09 16:21
- 阅读 ( 140 )
- 分类:科学
你可能感兴趣的文章
底物特异性(substrate specificity)和键特异性(bond specificity)的区别
...酶与特定的底物结合的方式。 目录 1. 概述和主要区别 2. 什么是底物特** 3. 什么是键特** 4. 并列比较-底物特**与键特**的表格形式 5. 摘要 什么是底物特**(substrate specificity)? 底物特**是指酶与特定底物结合的能力。这也被称为绝...
- 发布于 2020-09-21 22:30
- 阅读 ( 510 )
键能(bond energy)和键焓(bond enthalpy)的区别
关键区别-键能与键焓 键能和键焓都描述了同一个化学概念:将一摩尔分子分解成其组成原子所需的能量。它测量化学键的强度。所以也叫粘结强度。键能计算为气相化学物质在298K下的键离解能的平均值。键能和键焓这两个...
- 发布于 2020-09-24 09:39
- 阅读 ( 875 )
键偶极子(bond dipole)和分子偶极子(molecular dipole)的区别
...存在极性不同的两端的状态。 目录 1. 概述和关键区别 2. 什么是键偶极子 3. 什么是分子偶极子 4. 并列比较——键偶极子与分子偶极子的表格形式 5. 摘要 什么是键偶极子(a bond dipole)? 键偶极子是指在同一化学键中存在两个相反...
- 发布于 2020-10-01 16:53
- 阅读 ( 1020 )
键焓(bond enthalpy)和晶格焓(lattice enthalpy)的区别
键焓和晶格焓的关键区别在于,键焓是分解化学键所需的能量,而晶格能是从气态的阳离子和阴离子形成一摩尔离子化合物所需的能量。 这两个术语都描述了系统与其周围环境之间的能量交换。键焓与晶格焓相反。键焓解释...
- 发布于 2020-10-15 02:15
- 阅读 ( 435 )
均裂的(homolytic)和异溶键离解能(heterolytic bond dissociation energy)的区别
...和异溶键离解能的关键区别。 目录 1. 概述和主要区别 2. 什么是均裂键离解能 3. 什么是异溶键离解能 4. 并列比较-均裂和异溶键解离能的表格形式 5. 摘要 什么是均裂键离解能(homolytic bond dissociation energy)? 均溶键离解能是通过溶...
- 发布于 2020-10-19 07:36
- 阅读 ( 335 )
自由能(free energy)和焓(enthalpy)的区别
关键区别-自由能与焓 自由能和焓是两个热力学术语,用来解释热能与热力学系统中发生的化学反应之间的关系。自由能或热力学自由能是一个热力学系统能做的功的量。换言之,自由能是热力学系统中进行热力学功的可用能...
- 发布于 2020-10-19 11:40
- 阅读 ( 608 )
键能(bond energy)和键离解能(bond dissociation energy)的区别
...能是共价化学键的两个概念。 目录 1. 概述和主要区别 2. 什么是键能 3. 什么是键离解能 4. 并列比较-键能与键离解能的表格形式 5. 摘要 什么是键能(bond energy)? 当键形成时,释放出一定量的能量。相反,键断裂需要一些能量。...
- 发布于 2020-10-21 13:16
- 阅读 ( 766 )
结合(bonding)和反键分子轨道(antibonding molecular orbitals)的区别
...次占据一个分子轨道,两个电子占据同一个分子轨道。 什么是键合分子轨道(bonding molecular orbitals)? 键合分子轨道是由原子轨道通过原子轨道的同相结合而形成的。它增加了键合原子之间的电子密度。它们的能量低于原子轨道。...
- 发布于 2020-10-26 19:13
- 阅读 ( 640 )
焓(enthalpy)和熵(entropy)的区别
焓和熵之间的关键区别在于,焓是在恒定压力下发生的热传递,而熵给出了系统随机性的概念。 为了化学研究的目的,我们把宇宙分成两个系统和一个环境。在任何时候,我们要研究的部分是系统,其余的都是围绕着系统。...
- 发布于 2020-11-04 20:59
- 阅读 ( 1860 )
焓(enthalpy)和热(heat)的区别
焓和热之间的关键区别在于,焓是在恒压下化学反应过程中传递的热量,而热是能量的一种形式。 为了研究化学,我们把宇宙分成两个部分:一个系统和一个周围。系统是我们调查的对象,其余的是周围的。热和焓是描述系...
- 发布于 2020-11-05 19:40
- 阅读 ( 874 )